固体或液体体积与分子势能的关系
物质处于液态或固态时的分子势能大小不仅与温度和分子总数有关,还与分子间的平均距离及组成物质的分子之间的结构。有人认为物体受热时体积增大,分子间的平均距离变大,由于要克服分子引力做功,所以分子势能要增大;但是有些物质具有反常膨胀性质。在反常膨胀时,物体温度升高,而体积减小,分子间的平均距离减小,分子引力做正功,所以分子势能减小。因此,物体受热时,分子势能可能增加,也可能减小。以上认识是对分子势能大小变化的理解不够深刻而造成的一种错误认识。下面笔者就固体或液体体积的变化及其与分子势能变化的关系做一些分析,供大家参考:
一、固体(或液体)的热胀冷缩及其与分子势能变化的关系
一般固体(或液体)都有热胀冷缩的性质。现以双原子分子系统为例,对固体(或液体)的热胀冷缩现象及其与分子势能变化的关系分析如下:在固体(或液体)中,由于分子在平衡位置 r=r0 附近处的动能小于势能的绝对值,所以分子不能自由移动而只能在平衡位置附近做微小振动。分子的动能和势能的总量 E总 为负值,其图线在r 轴下方(与 r 轴平行),如图1所示。取某一分子为参考系,并取其所在位置为坐标原点0,假设另一分子从位置r =r2 ( r2>r0) 处由静止开始向该分子靠近(开始运动时分子动能为零,E总 = Ep ),由于分子力为引力,分子间作用力做正功,使系统分子势能减小,分子动能增加;当 r=r0 时分子力为零,分子势能最低,分子动能最大;此后分子间距离继续减小;当 r< r0 时,分子力为斥力,分于力做负功,分子势能
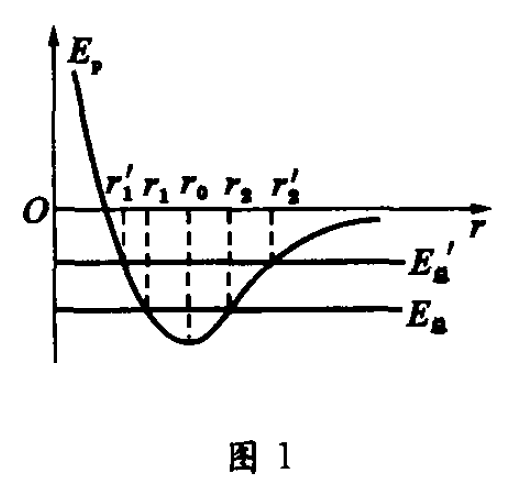
增加,分子动能减小。当r =r1 (即 E总 线与 Ep 线左边交点对应的r值)时,分子势能最大(Ep 一E总 ),此时分子动能为零;此后分子又在强大斥力作用下返回,分子势能减小,分子动能增加;当r=r0 时,分子势能又回到最低,分子动能最大。当分子回复到 r=r2 的位置(即E总 线与Ep 线右边交点对应的 r 值)时,又有Ep=E总,此时分子动能又全部转变为分子势能。然后分子又被拉回去,如此分子便在 r1 和 r2 之间做往复振动。此时分子之间的平均距离ra =(r1+r2)/2。当温度升高时,系统从外界吸收能量,分子系统的总能量增加,E总 线上移至E总' ,分子之间的平均距离为ra'= (r1' +r2' )/2。由于势能曲线不对称,使得ra '> ra。即分子间的平均距离增大,所以物体温度升高时,体积膨胀;反之.当物体温度降低时,分子间的平均距离减小,体积收缩。这就是固体和液体的热胀冷缩.实际上,由于物质是由大量分子组成的,分子间动能和势能的转化远比上述过程复杂得多,但在任一时刻.任意两个分子间动能和势能相互转化程度的概率是确定的.所以.当物体的物态、温度、体积一定时,所有分子间势能的总和就有确定的值,此即为物体的总的分子势能。当物体温度升高时,分子动能为零时的分子势能 (此时 Ep= E总' ) 比原来温度低时增加了,由于任意两个分子间动能和势能相互转化程度的概率确定。物体内所有分子处于从势能为零到最大值之间任一状态的概率分布是确定的,故总的分子势能必然增加;反之,当物体温度降低时,分子势能也随之减小。由此可知:当固体和液体受热时膨胀,分子势能增加;遇冷时收缩,分子势能减小。认为物体受热时由于膨胀而使分子间的平均距离变大,因克服分子引力做功而使分子势能增大的观点是笼统的,不全面的.
二、固体或液体的反常膨胀及其与分子势能变化的关系
有些固体或液体(如水、锑、铋、液态铁等)在一定的温度范围内(如水在0℃ ~4℃ 之间),温度增加时体积不但不增加,反而减小.我们称之为反常膨胀.物体的反常膨胀与热胀冷缩的机理不同,其体积的变化与分子势能变化的关系不能只用分子间的平均距离的变化解释,还要结合组成物质的分子之间的结构变化来解释.我们知道:固体和液体是靠分子间的结合力形成的.这种靠结合力形成的多分子结构对应着与双分子系统相似的作用势能.分子之间结合力的性质不同,形成的结构也不同,对应的势能也不同.下面以水为例,对液体的反常膨胀及其与分子间势能变化的关系分析如下:
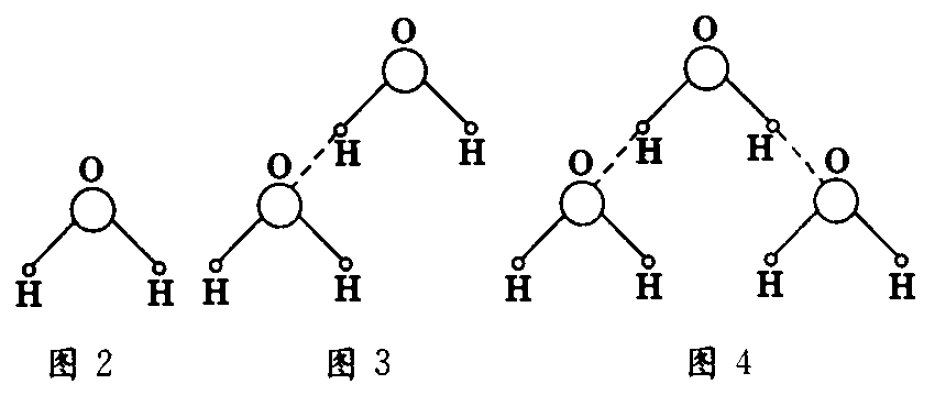
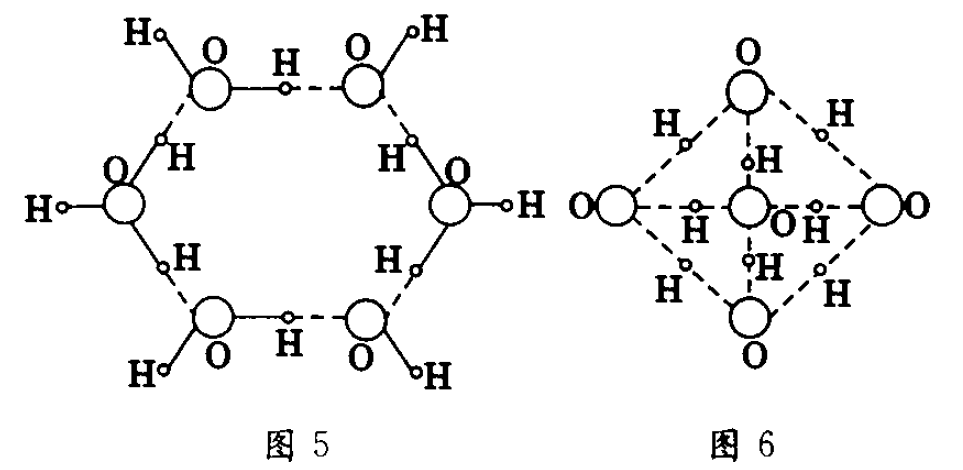
常温下,水中的氢原子与电负性很大的氧原子以共价键结合成水分子,如图2所示.由于氢原子显正电性,氧原子显负电性,从而可使水分子之间互相吸引,形成氢键,如图3所示.这样相邻的氢原子与氧原子就以氢键连在一起,形成缔合水分子,同时放出热量.图4、图5分别为三分子、多分子的缔合水分子的示意图.由于氢键具有一定的方向性,因此在单个水分子组合为缔合水分子后.水的结构便发生了变化.
多个水分子组合时,除了呈六角形外,还可形成如图6所示的立体形点阵结构.即每一个水分子都通过氢键与周围四个水分子组合在一起连接成四面体.形成一个多分子的缔合水分子.由图可知,这种多个分子组合成的缔合水分子中的水分子排列得比较松散.中间出现“透空”结构,分子的间距也比较大.
一般情况下,水中既存在大量单个水分子(H!()),也存在多个水分子组合在一起的缔合水分子”(H!()).常温下有大约5O 的单个水分子组合为缔合水分子,其中双分子缔合水分子最稳定.质量一定的水,其体积受水分子的缔合作用、水分子的热运动两个因素影响.当温度升高时,水分子的热运动加快,缔合作用减弱;当温度降低时,水分子热运动减慢,缔合作用加强.
先从固态的冰(0℃ )说起:一定质量的冰处于固体状态(0 oC)时.全部水分子缔合在一起形成四面体结构,其中有较大的空隙,故密度较小,体积较大.将冰加热熔化成水时,缔合水分子中的一些氢键断裂,体积减小,由于克服结合力做功要消耗一部分能量,所以分子之间势能增加.实际上,0℃ 的水中大约只有1 5% 的氢键断裂,水中仍然存在约85 的大的缔合水分子.若继续加热0 oC的水,随着水温度的升高(约0℃ ~4oC),大的缔合水分子逐渐变为小的缔合水分子或单个水分子,这时缔合水分子分解时仍然要克服结合力做功,因而分子间总势能还要增加.这些小的缔合水分子或单个水分子,受氢键的影响较小,可以任意排列和运动,不能形成“透空”结构.所以水的总体积减小.当水温升高的过程中.一方面,缔合数小的缔合水分子、单个水分子在水中的比例逐渐增加,水的体积随之减小,分子间总势能增加.随着温度的升高(大于4℃),水分子的热运动加快,使得单个分子之间的平均距离加大,体积增大,分子势能也增加(此时分子势能的变化与物体热胀冷缩时的原理相同).在0 oC~4℃ 的过程中,由缔合水分子氢键断裂引起水的体积减小的趋势;比由分子热运动速度加快引起水的体积增大的趋势更大,因此.在0 oC~4℃ 的范围内.水的体积随温度的升高而减小,表现为反常膨胀,但其分子间总势能却是增加的,这是由于克服缔合水分子间的结合力做功而引起的.当水的温度大于4℃ 时.水发生的是热胀冷缩现象.
总体上说,一定质量的物体(固态或液态)温度升高时无论体积如何变化,其分子势能都是增加的.我们不能简单地从固体或液体的体积变化上判断分子的势
能是增加还是减小,而应该从体积变化的原因上去分析.才能抓住问题的本质,而且让学生弄清为什么物体温度升高分子势能一定增加的道理.