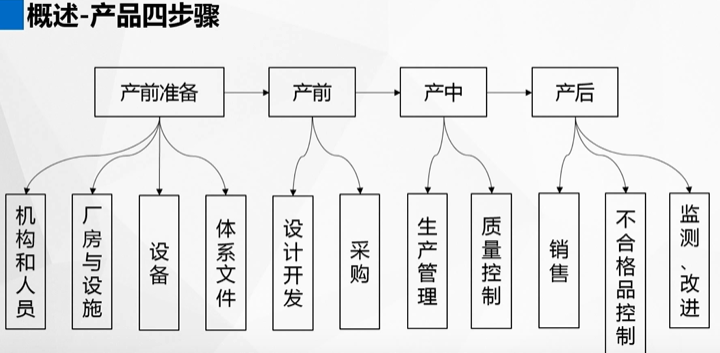
产前
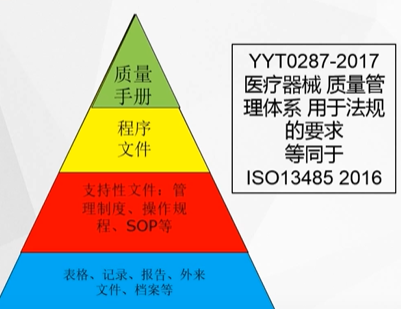
产前准备 - 体系文件

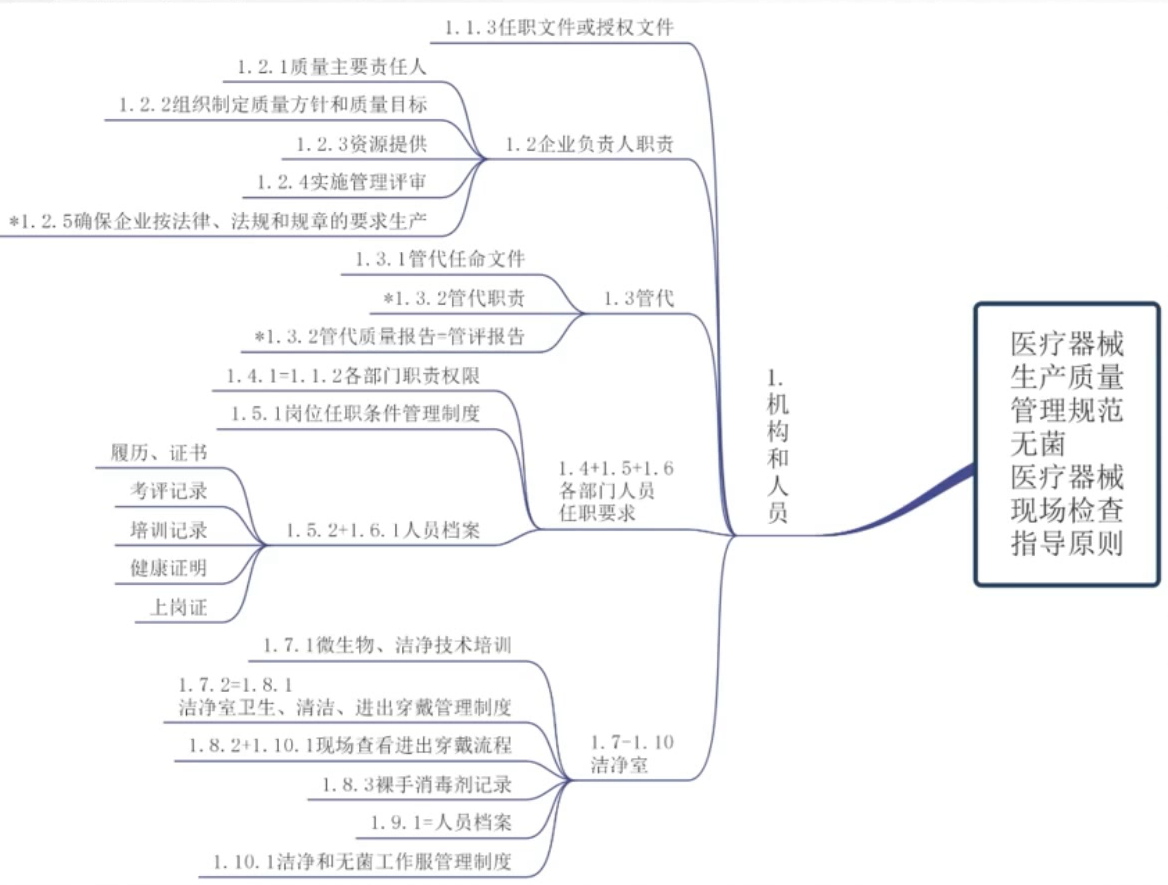
产前准备 - 机构和人员
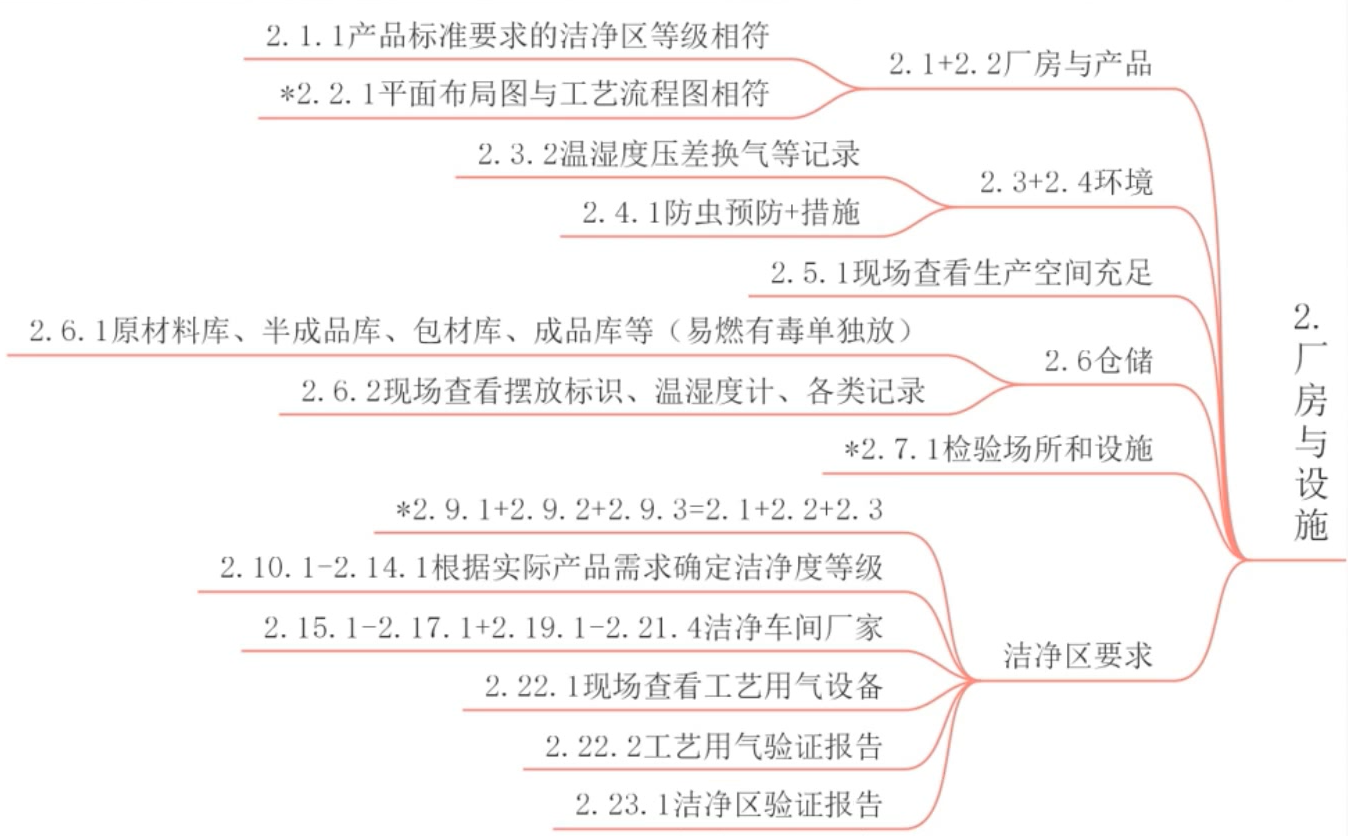
产前准备 - 厂房与设施
产前准备 - 设备

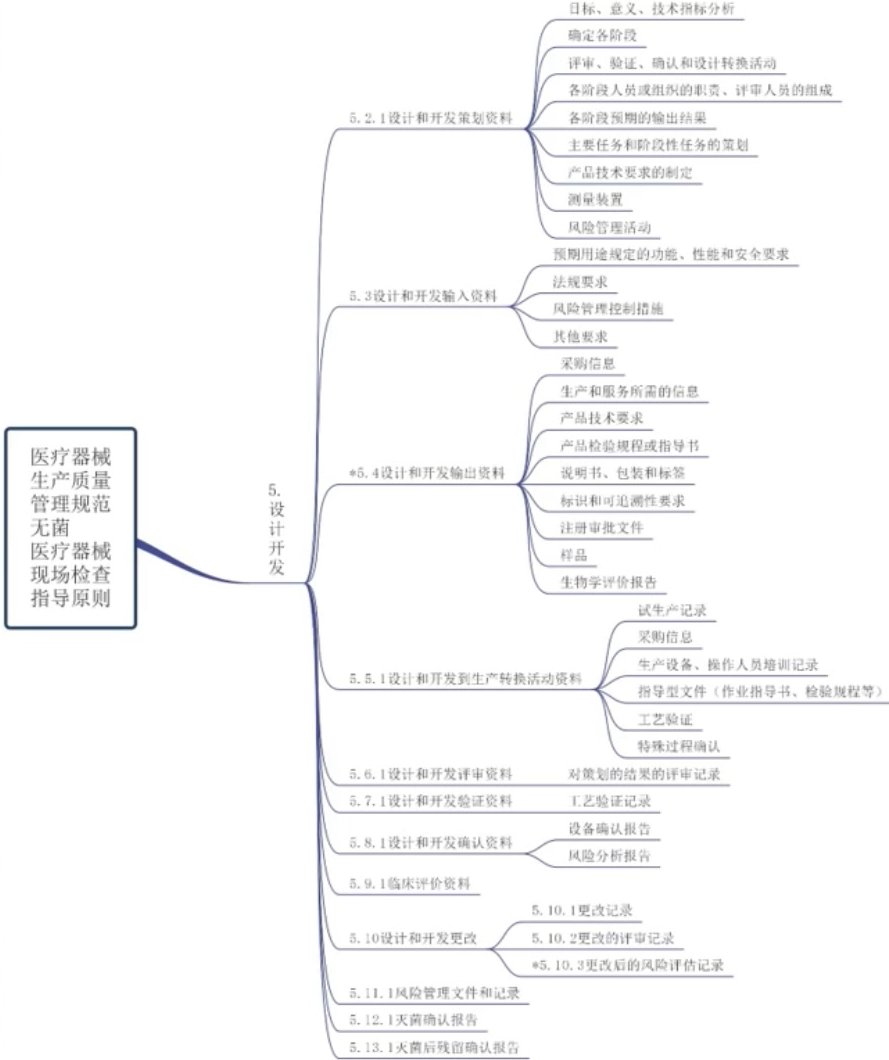
产前 - 设计开发
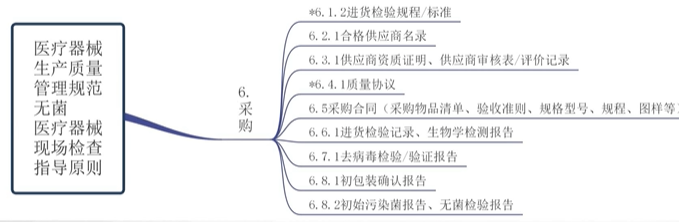
产前 - 采购
产中
产中 - 生产管理

产中 - 质量管理

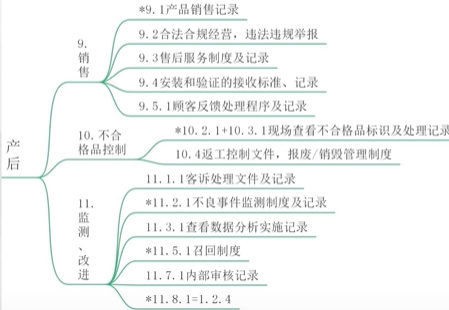
产后
总结
设计开发
设计开发程序文件、计划书、图纸、工艺流程、工艺规范、设备人员要求、评审报告、验证方案、验证报告、确认报告等。
采购
采购清单、供方评价(如评价准则、评价记录、评价结果)、合格供方名录、采购合同、采购记录、进货检验记录、验收标准、检验报告等
采购控制程序、原材料的相关质量标准、验证报告,以及供应商的相关信息
生产管理
工艺流程图、关键工序/特殊过程控制点、操作规程(如作业指导书、工艺卡等)、生产记录、留样等
生产检验
设备检验规程、试验记录,批生产检验记录,确定检测过程是否真实、可靠、可追溯
其他
安全有效清单,及清单中相关证据的原始资料。
风险点的控制方法及有效性确认
设计转换后的不合格品的记录、评审和处理措施。
医疗器械监督管理条例
概述
医疗器械分类、注册
医疗器械生产、经营、使用
不良事件监测
法律责任
概述
概述医疗器械(第七十六条)
1.1概念
直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品或软件。
1.2效用
通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用
1.3目的
(一)疾病、损伤的诊疗
(二)生理结构或者生理过程的检验、替代、调节或者支持;
(三)生命维持;(直接或者阆接用于人琳体的仪器设备齐器具
概述 - 中国医疗器械法律法规
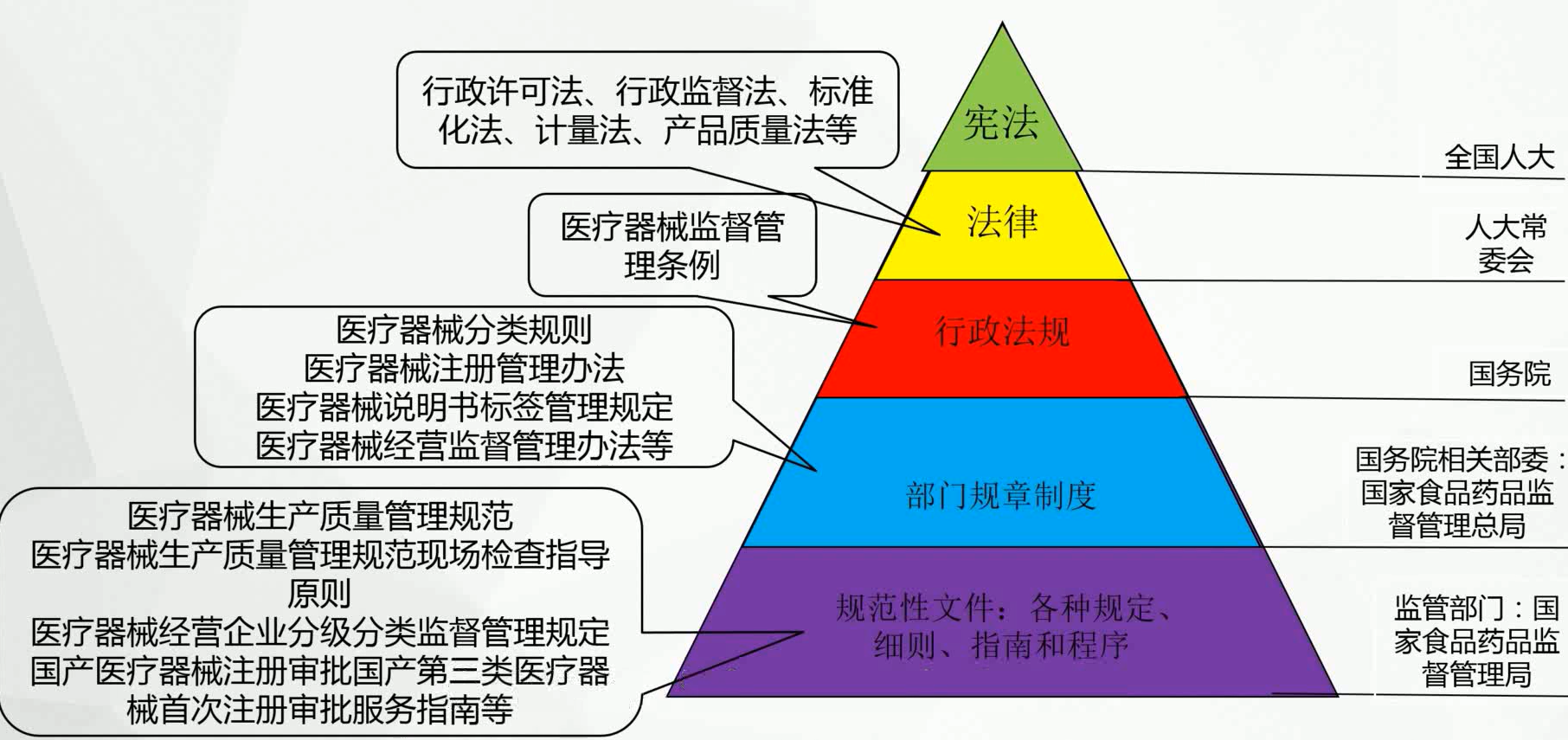
概述 - 医疗器械监管制度设计框架图

概述 - 医疗器械监督管理条例
2014年6月1日国务院颁布实施现行《医疗器械监督管理条例》
2017年5月4日国务院对《医疗器械监督管理条例》进行了修订。

医疗器械分类、注册
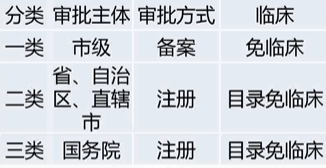
医疗器械分类 - 第四条
第四条 国家对医疗器械按照风险程度实行分类管理。
第一类(Ⅰ类)是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
举例:普通手术器械、手动手术床、听诊器、负压罐、医用棉球、纱布绷带.
第二类(Ⅱ类)是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械
举例:心电图机、电动手术床、血压计、磁疗机、穿刺针、生化分析仪、血细胞分析仪、尿液分析仪等。
第三类(Ⅲ类)是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
举例∶CT、核磁共振、人工心脏起搏器、血管支架骨螺钉、医用呼吸机、钢板等。
医疗器械分类 - 医疗器械分类目录
2.1制定依据
《医疗器械监督管理条例》《医疗器械分类规则》
2.2实施
2018年8月1日正式实施现行《医疗器械分类目录》
2.3分类
执行分类规则指导下的目录分类制,按《医疗器械分类目录》进行分类确定。
对新硏制的尚未列入分类目录的医疗器械,申请人可以依照本条例有关第三类医疗器械产品注册的规定直接申请产品注册,也可以依据分类规则判断产品类别并向国务院食品药品监督管理部门申请类別确认后依照本条例的规定申请注册或者进行产品备案。(堡疗器械的分类是由医疗器械分类目录来决定的
(一)无源医疗器械:不依靠电能或者其他能源,但是可以通过由人体或者重力产生的能量,发挥其功能的医疗器械
(二)有源医疗器械:任何依靠电能或者其他能源,而不是直接由人体或者重力产生的能量,发挥其功能的医疗器械
(三)接触人体器械:直接或间接接触患者或者能够进入患者体内的医疗器械。
(四)ⅣD体外诊断产品( in vitro diagnostic products)
可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品物)等
医疗器械注册 - 第二章
第九条 备案或注册应当提交下列资料
(一)产品风险分析资料
(二)产品技术要求
(三)产品检验报告
(四)临床评价资料;
(五)产品说明书及标签样稿;
(六)与产品硏制、生产有关的质量管理体系文件;
(七)证明产品安全、有效所需的其他资料。
《医疗器械注册管理办法》、《医疗器械注册单元划分指导原则》
第十四条已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续;发生非实质性变化,不影响该医疗器械安全、有效的,应当将变化情况向原注册部门备案。
第十五条医疗器械注册证有效期为5年。有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门提岀延续注册的申请。
有下列情形之一的,不予延续注册
(一)注册人未在规定期限内提出延续注册申请的
(二)医疗器械强制性标准已经修订,申请延续注册的医疗器械不能达到新要求的
(三)对用于治疗罕见疾病以及应对突发公共卫生事件急需的医疗器械,未在规定期限内完成医疗器械注册证载明事项的
第十八条开展医疗器械临床试验,应当按照医疗器械临床试验质量管理规范的要求,在有资质的临床试验机构进行,并向临床试验提岀者所在地省、自治区、直辖市人民政府食品药品监督管理部门备案。
《医疗器械临床试验质量管理规范》
第十九条第三类医疗器械进行临床试验对人体具有较高风险的,应当经国务院食品药品监督管理部门批准。临床试验对人体具有较髙风险的第三类医疗器械目录由国务院食品药品监督管理部门制定、调整并公布。
《需进行临床试验审批的第三类医疗器械目录》
医疗器械生产、经营、使用
医疗器械生产 - 第三章
第二十条从事医疗器械生产活动,应当具备下列条件
(一)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员
(二)有对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备
(三)有保证医疗器械质量的管理制度
(四)有与生产的医疗器械相适应的售后服务能力;
(五)产品研制、生产工艺文件规定的要求
《医疗器械生产监督管理办法》
第二十一条、第二十二条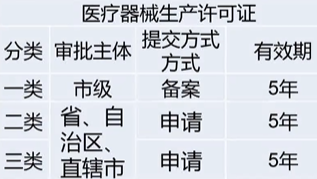
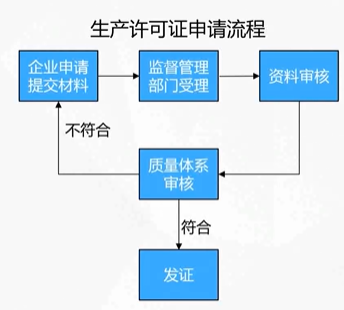
第二十三条、第二十四条、第二十五条
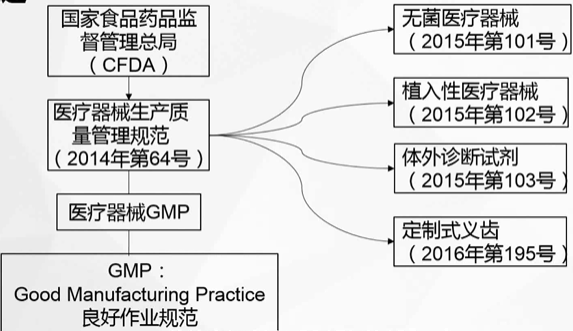
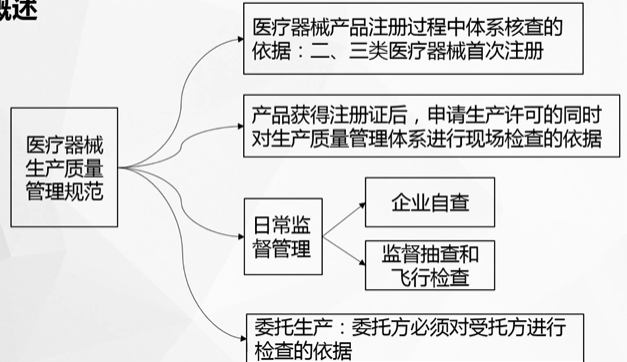
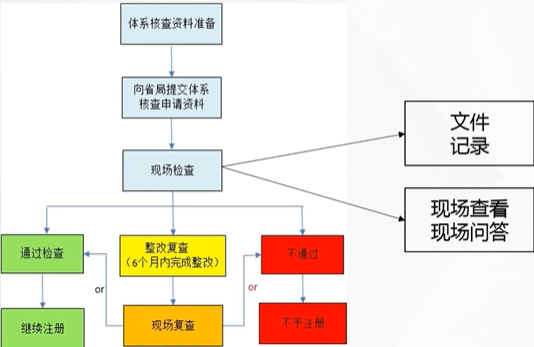
《医疗器械生产质量管理规范》
第二十六条医疗器械应当使用通用名称
《医疗器械通用名称命名规则》
《医疗器械通用名称命名指导原则》
第二十七条医疗器械说明书、标签
说明书:由医疗器械注册人或备案人制作,随产品提供给用户,涵盖该产品安全有效的基本信息,用以指导正确安装、调试、操作、使用、维护、保养的技术文件。
标签:在医疗器械或包装上附有的用于识别产品特征和标明安全警示等信息的文字说明及图形、符号,
《医疗器械说明书和标签管理规定》
第二十八条委托生产
委托方对所委托生产的医疗器械质量负责,委托方必须对受托方进行医疗器械生产质量管理进行检查。
具有高风险的植入性医疗器械不得委托生产
《禁止委托生产医疗器械目录》
医疗器械经营 - 第四章
第二十九条、第三十条、第三十一条 《医疗器械经营监督管理办法》
第三十二条 第二类、第三类医疗器械批发业务以及第三类医疗器械零售业务的经营企业,还应当建立销售记录制度。
第三十三条运输、贮存 《医疗器械冷链(运输、贮存)管理指南》
第三十四条 - 第四十一条
1、应对人员培训、按说明书要求使用医疗器械。
2、对重复使用的医疗器械消毒处理,一次性使用的不得重复使用。
3、定期检査、校准、维护器械并记录,确保医疗器械处于良好状态。
4、保存第三类医疗器械的原始资料
5、对大型医疗器械,逐台建立使用档案。
6、发现医疗器械存在安全隐患,停止使用,通知生产企业进行检修。
7、使用单位之间转让在用医疗器械,转让方应当确保所转让的医疗器械安全、有效
《医疗器械使用质量监督管理办法》
第四十五条医疗器械广告应当真实合法,不得含有虚假、夸大、误导性的内容
医疗器械生产企业向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交审批。
《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法》
不良事件监测
不良事件 - 不良事件处理
医疗器械不良事件:指获准上市的质量合格的医疗器械在正常使用情况下发生的导致或可能导致人体伤害的各种有害事件。
第四十七条生产经营企业和使用单位应建立不良事件监测管理制度,发现医疗器械不良事件及时上报。
第四十八条国家建立医疗器械不良事件监测制度,对不良事件进行收集、分析、评价、控制
《医疗器械不良事件监测和再评价管理办法》
《医疗器械注册人开展不良事件监测工作指南》
不良事件 - 已上市产品再评价
第五十一条有下列情形之一的,省级以上人民政府食品药品监督管理部门应当对已注册的医疗器械组织开展再评价
(一)根据科学研究的发展,对医疗器械的安全、有效有认识上的改变的
(二)医疗器械不良事件监测、评估结果表明医疗器械可能存在缺陷的
(三)国务院食品药品监督管理部门规定的其他需要进行再评价的情形
不良事件 - 召回制度
第五十二条
召回条件∶不符合强制性标准、经注册或者备案的产品技术要求或者存在其他缺陷的。
措施:采取补救、销毁等措施,记录相关情况,发布相关信息,并将医疗器械召回和处理情况向食品药品监督管理部门和卫生计生主管部门报告。
《医疗器械召回管理办法》
监督检查-第六章
第五十三条重点监督检查项目
(一)医疗器械生产企业是否按照经注册或者备案的产品技术要求组织生产
(二)医疗器械生产企业的质量管理体系是否保持有效运行
(三)医疗器械生产经营企业的生产经营条件是否持续符合法定要求。
《医疗器械质量抽査检验管理办法》
法律责任
法律责任第七章
第六十三条有下有下列情形的,没收违法所得、医疗器械和设备原材料等物品;罚款;情节严重的,5年内不受理医疗器械许可申请
(一)生产、经营未取得注册证的二,三类器的
(二)未经许可从事二、三类器械生产活动的。
(三)未经许可从事三类器械经营活动的
法律责任-第七章
第六十四条提供虚假资料取得注册证、生产许可证、经营许可证、广告批准文件的,撤销已经取得的许可证件,处5-10万元罚款,5年内不受理许可申请伪造、变造、买卖、岀租、岀借相关医疗器械许可证件,收缴或吊销相关证件,没收违法所得;罚款。
第六十五条未按规定备案的限期改正;逾期不改正的,公告单位和产品名称,处1万元以下罚款
备案时提供虚假资料的,公告备案单位和产品名称;情节严重的,责任人5年内不得从事医疗器械生产经营活动
第八十六条有下列情形的,责令改正,没收医疗器械;罚款;情节严重的,责令停产停业,直至吊销注册证,生产许可证、经营许可证
(一)生产、经营、使用不符合强制性标准或不符合产品技术要求的医疗器械的;
(二)未按照经注册或者备案的产品技术要求组织生产,或者未建立质量管理体系并保持有效运行的
(三)经营、使用无合格证明文件、过期、失效、淘汰、未依法注册的医疗器械
(四)责令实施召回或者停止经营,仍拒不召回或者停止经营医疗器械的
(五)委托不具备规定条件的企业生产,或者未对受托方的生产行为进行管理的
第六十七条有下列情有下列情形的,责令改正,罚款;情节严重的令停产停业,直至吊销生产许可证、经营许可证
(一)生产条件发生变化、不符合医疗器械质量管理体系要求,未按规定整改、停止生产、报告的
(二)生产、经营说明书、标签不符合规定的医疗器械的
(三)未按说明书标签要求运输,贮存医疗器械的
(四)转让过期、失效、淘汰或检验不合格的医疗器械的。
第六十八条有下列有下列情形的,责令改正,给予警告、拒不改正的,罚款情节严重的,责令停产停业,直至吊销生产许可证、经营许可证
(一)未按照要求提交质量管理体系自查报告的
(二)经营企业、使用单位未建立。执行医疗器械进货査验记录制度的
(三)二类、三类批发及三类零售的经营企业未建立并执行销售记录制度的
(四)对重复使用的医疗器械,使用单位未按照消毒和管理的规定迸行处理的
(五)使用单位重复使用一次性使用的医疗器械,或者未按照规定销毁的
(六)使用单位未按要求检査、检验、校准、保养、维护并予以记录,及时进行分析、评估,确保医疗器械处于良好状态的
(七)使用单位未妥善保存三类医疗器械的原始资料,或者未将大型医疗器械以及植入和介入类医疗器械的信息记载到病历等相关记录中的
(八)使用单位发现使用的医疗器械存在安全隐患未立即停止使用的;
(九)生产经营企业、使用单位未开展医疗器械不良事件监测,未按要求报告不良事件,或对不良事件调查不予配合的。
第六十九条违反规定开展医疗器械临床试验的,罚款;有医疗器械临床试验机构资质的,撤销资质。
临床试验机构出具虚假报告的,撤销资质。
第七十条检验机构出具虚假检验报告的,撤销检验资质。
第七十一条发布未取得批准文件的医疗器械广告的,未核实批准文件的真实性即发布医疗器械广告;发布内容与批准文件不一致的医疗器械广告的,由工商部门工商部门依照有关法律法规给予处罚。
篡改经批准的医疗器械广告内容的,撤销广告批准文件,2年内不受理其广告审批申请。
发布虚假医疗器械广告的,暂停销售,向社会公布;仍然销售的,没收医疗器械,并处2-5万元罚款。