钙离子在很多生理活动中都发挥着重要作用,除了在肌肉细胞收缩中扮演着重要角色,钙离子也是神经元活动的重要“风向标”之一:当神经元膜电位发生去极化,产生的动作电位传导到神经元轴突末梢时,细胞膜上的电压门控钙离子通道打开,大量钙离子内流,包含神经递质的囊泡由突触前膜释放至后膜,下游神经元就得以接受到上游的信号。因此,钙离子成像可以追踪神经元动作电位,从而帮助我们了解神经元集群的活动,可以用于感知觉,学习记忆,社会性行为等各种各样的研究中。

图1 Prime 95B 拍摄的小鼠大脑嗅球区域接受嗅觉刺激时的钙离子信号 (Thy1-GCaMP6f-GP5.11)(From Dr. David Gire, 华盛顿大学心理学系)
钙离子指示剂
想要对钙离子的动态变化进行有效的检测,钙离子指示剂的选择显得尤为重要。钙离子荧光指示剂在未结合钙离子前几乎无荧光,与钙离子结合后,荧光强度显著增强。利用这一原理,可以通过指示剂的信号强弱来观察细胞内钙离子浓度水平的变化。
根据激发光波长范围,钙离子指示剂可以分为可见光激发和紫外光激发,而根据其工作原理又可以分为比率和非比率型。下面我们就来详细了解一下几种常见的钙离子指示剂:
1. 紫外光激发Ca2+荧光探针
Fura-2 和 Indo-1 都是紫外光激发的双波长 Ca2+ 荧光指示剂,也是目前最常用的比率型钙离子荧光探针。与其他第一代的荧光指示剂相比,它们的荧光信号更强,对Ca2+ 的选择性也更强。
比率指示剂会在与 Ca2+ 结合后会改变吸收/发射特性。以双波长激发指示剂 Fura-2 为例。如图 2 所示,低 Ca2+ 浓度下,Fura-2 在 ~380nm 处激发,高 Ca2+ 浓度下,在 ~340nm 处激发。光谱由两个峰组成:左侧较短波长的吸收峰随 Ca2+ 浓度的增加而增大,右侧较长波长的吸收峰随 Ca2+ 浓度的增加而减小。通过 340/380nm 交替激发,获取在 510nm 处对应的发射光荧光强度的比率,就可以对 Ca2+ 浓度进行定量的测量。因为 Fura-2 结果准确,且不易被漂白,所以得到了广泛使用。
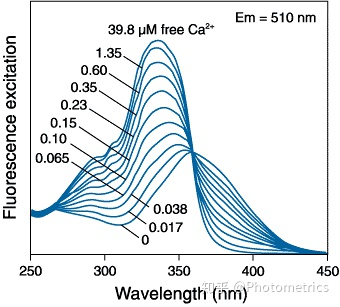
图2 Fura-2 激发光谱(Ca2+ 浓度0-39.8 μM)
还有另一种双波长发射指示剂 Indo-1,在 340nm 处用单一波长激发,在 400nm 和 480nm 处分别检测结合和未结合 Ca2+ 的荧光信号,通过二者的比率确定 Ca2+ 浓度。它的优点与 Fura-2 相似,但更容易被漂白,应用时需要尽量减少激发光强和照射时间。
使用比率型指示剂标定 Ca2+ 浓度可以消除实验中的一些干扰和不确定性,如染料分布不均匀,染料吸收差异,细胞运动,自发荧光,细胞厚度差异等。不过,大多数比率指示剂必须在 400nm 以下被激发。而用紫外/近紫外光照射细胞可能导致细胞死亡(凋亡),特别是在长时间实验中。
2. 可见光激发Ca2+荧光探针
与紫外光激发探针相比,可见光激发 Ca2+ 探针具有更强的染料吸收性能,对 Ca2+ 变化水平检测敏感度也更高,能够降低对活细胞的光毒性和样品自发荧光以及光散射的干扰,且无光谱偏移。最常使用的可见光激发 Ca2+ 荧光探针有 Fluo-3,Fluo-4,Rhod-2 等,同时他们也都是非比率型指示剂。
Fluo-3 是最常用的可见光激发 Ca2+ 荧光指示剂之一,是典型的的单波长指示剂,最大激发波长为 506nm,最大发射波长为 526nm。它与 Ca2+ 结合之前几乎无荧光,结合后荧光会增加 60 至 100 倍,从而避免了细胞自身的荧光干扰。实际检测时推荐使用的激发波长为 488nm 左右,发射波长为 525~530nm(图 3)。Fluo-3 可以用在激光共聚焦显微成像或流式细胞仪中。它还有一个升级版本 Fluo-4,在相同 Ca2+ 浓度下信号更强。
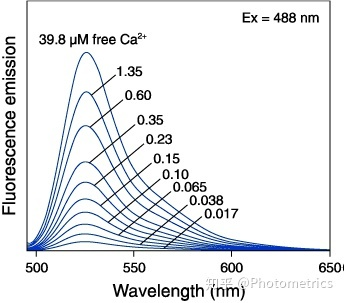
图3 Fluo-3 发射光谱(Ca2+ 浓度0-39.8 μM)
Rhod-2 是另一种可见光激发的高亲和力 Ca2+ 指示剂,与 Fluo-3/4 相比,Rhod-2 激发和发射波长都更长。在 540nm 处被激发,发射波长在 580nm 以上,更适用于具有较高自发荧光现象的细胞和组织。
3. 转基因 Ca2+ 指示剂
转基因技术和光遗传技术的飞速发展,催生了基因编码的 Ca2+ 指示剂(GECIs)。它们不依赖于荧光染料,可以靶向特定的组织,如神经细胞、心肌细胞、T细胞等,并且可以避免荧光指示剂带来的的许多问题,是监测活体转基因动物体内钙离子的一个极好的工具。
第一个基因编码的钙离子指示剂 Cameleon 早在1997年就发表了。它是利用与钙离子结合后发生结构变化,作为供体的 CFP 和作为受体的 YFP 之间产生 FRET 的原理(图 4)。
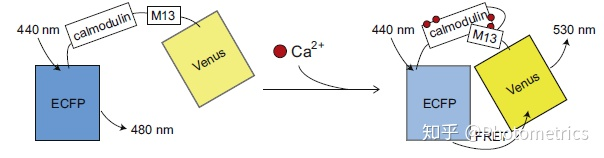
2000年,GCaMP 诞生了。它是增强型绿色荧光蛋白(EGFP)和钙调蛋白(结合钙离子)、钙调蛋白结合肽 M13 组成的,结合钙离子后,钙调素-M13相互作用引起GFP空间结构变化,发出绿色荧光(图 5)。GCaMP 的问世有着革命性的意义,它改变了我们观察神经元群体活动的方式,让科学家们可以在成千上万的细胞中,看到哪些神经元在放电,它们放电的模式和规律是怎样的,从而进一步探索各种内在的神经机制。

GCaMP 显著增加了发射光强度,可以同时对钙离子和其他感兴趣的结构进行成像。此后,GCaMP 经历了各种迭代,变得更亮更快。此外,还发表了红色荧光版RCaMP,避免紫外/近紫外激发带来的的副作用。
钙离子成像系统
传统的宽场荧光显微镜由于光散射的影响,只能够对大脑浅层的神经元或在离体组织上进行成像,共聚焦显微镜由于光损伤较大,一般也只用于离体钙成像。
随着荧光显微镜技术的迅速发展,在体钙成像技术得到了蓬勃发展。双光子荧光显微镜能够在进行活体成像的时候实现高分辨率和高信噪比。例如,用双光子显微镜对海马树突棘的钙离子信号进行成像,研究神经元突触后长时程抑制 (Wang et al., 2000);观察活体小鼠运动皮层神经元在嗅觉选择任务中刺激相关电位 (Komiyama et al., 2010)等等。不过,这些实验还是需要对动物进行麻醉和固定,而神经科学领域很多研究更希望能够对自由活动的动物进行研究。
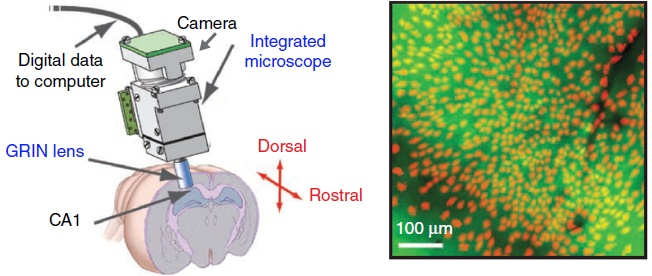
近年来出现了通过植入性的 microscope 或 microlens 进行活体 freely moving 动物钙成像的技术。如图 6 中所示的光纤成像法:使用一端带有 GRIN lens 的光纤连接显微镜和动物大脑,从特定脑区发出的荧光信号被光纤收集,然后通过相机成像。动物头部只需植入 GRIN lens,方便活动,而且可以同时植入多个 lens 来观察不同的脑区之间的联系和相互作用。不过这种成像方法的视野较小,分辨率也比较差。
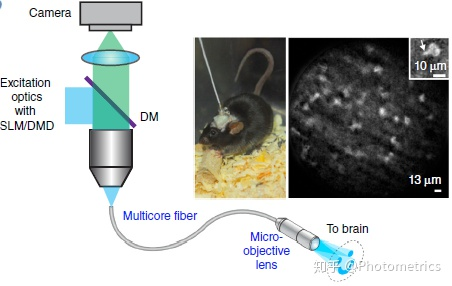
图6 光纤微透镜成像(Epifluorescence fiberscope)(Yang & Yuste, 2017)
图 7 所示的直接植入动物大脑的微型荧光显微镜,将 GRIN lens 直接植入皮层下的海马,下丘脑,丘脑等区域,可以监测深部脑区的神经元活动。这种微型显微镜的重量只有几克,不会影响动物自由活动,可以提供 800μm × 600μm 视野和 1.50μm 横向分辨率。和光纤成像一样,这种植入型的钙成像设备对手术的要求很高,损伤也比较大。
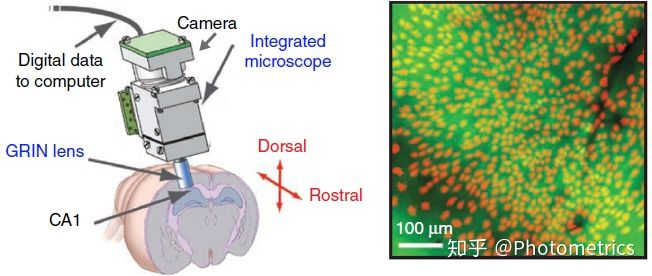
图7 微型荧光显微镜(Epifluorescence miniature microscope)(Yang & Yuste, 2017)
相机选择
多种钙离子指示剂和钙成像手段的存在使研究人员能够根据具体的实验需要进行选择。同样,选择合适的检测设备也是至关重要的。对于使用 CCD/sCMOS 相机的成像系统来说,有两个要求是最基本的:
采集速度:根据不同的应用所需的相机帧速也不同,对于神经细胞来说,一般要求相机速度至少在 10fps 以上,有些高速应用场景可能需要几百甚至上千 Hz 的帧速。
灵敏度:为了尽可能降低光漂白和其他副作用(特别是蓝光激发时),需要降低激发光强度。因此相机要在较宽的发射光波长范围上具有高灵敏度,才能检测到弱光条件下的信号,并适应不同的染料的光谱发射特性。
此外,在一些特定研究中,相机的视野也是一个重要因素。当研究在神经元中表达 GECIs 的器官型脑片的行为时,例如想要同时观察轴突和树突的钙离子信号,大视野是很重要的。而在膜片钳系统上。只对单个细胞成像的情况下,通常使用低放大倍率和低数值孔径的物镜,这时候相机视野较小也问题不大。
对于钙离子成像来说,大多数情况下速度更为重要,所以一般会牺牲分辨率。过去,EMCCD 由于其高灵敏度、高QE和高速而被广泛应用。如今,背照式 sCMOS 相机(图8)由于具有相当的灵敏度和更高的速度而更受欢迎。