背景
ICU 患者存在共疾病的情况,对于确定相应的营养支持存在困难。
当前指南:确定营养的时机、途径、剂量和组成,结合急性代谢变化、能量和蛋白质是否缺乏。采用的方式是通过观察和回顾患者的历史数据。
本文目的是阐明领域知识,实现对ICU患者的最佳营养支持方案。以便为未来的临床研究提供优先事项。
术语
Medical nutrition therapy : 包含口服营养补充剂、肠内营养和肠外营养的术语。后两者通常被称为”人工营养“。
Actual Body Weight : 服药前的”干“体重(没有注入液体的体重)。BMI: (weight (kg) = 2.2 *BMI + 3:5 * BMI * (height - 1:5 m).
Ebb phase and Flow phase : Ebb 阶段包括血液动力学不稳定的超急性早期阶段,导致进入ICU,而 Flow 阶段包括代谢不稳定和代谢分解的后续阶段,合成代谢。
Acute phase and Post-Acute phase : 是 Flow 阶段的组成部分,Acute急性期由早期的代谢不稳定和分解代谢严重增加,和晚期的显著肌肉消耗和代谢紊乱。Post-Acute是伴随着改善和康复或持续的炎症/分解代谢状态和延长住院的时间。
Isocaloric diet : 等热量饮食是围绕既定目标的能量管理。
Hypocaloric or underfeeding : 低能量或喂养不足是低于规定目标的70%的能量消耗。
Trophic feeding : 营养喂养是具有有益效果的营养物的最小给药。
Overfeeding : 是超过规定目标10%的能量消耗。
Low protein diet : 低蛋白饮食蛋白质给药低于0.5g/kg/天。
临床问题及建议
1. 所有住在重症监护室的患者都应考虑药物营养治疗,主要是48小时以上的患者。
讨论:48小时开始早期营养,对其禁忌症能更好的确定。渐进式地引入对严重营养不良或入院前处于饥饿状态的患者有益。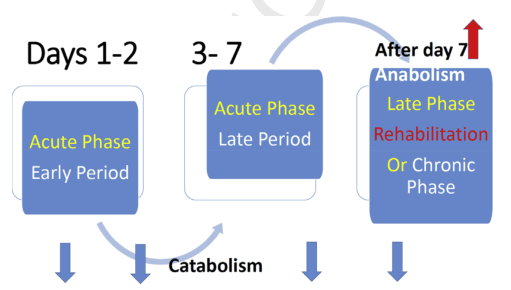
2. ICU患者应进行一般临床评估,以评估重症监护室中的营养不良。
备注:一般临床评估可能包括既往病史、ICU入院前意外体重减轻或体能下降的报告、体格检查、身体成分的一般评估以及肌肉质量和力量(如果可能)。
讨论:在 ICU 很难评估体重变化,因为液体给药和肌肉组织的快速消耗。所以体重和BMI并不能准确反映营养不良。而肥胖患者体重减少却是常见的,构成营养不良的条件,并且体重减轻或肌肉量减少越大,营养不良越严重。
2.1. 评估实验室工具:
炎症通常与C反应蛋白(CRP)升高和低白蛋白血症有关,所以白蛋白和前白蛋白水平不是营养状态的良好标志,低值是对炎症的反应(阴性急性期蛋白)。白蛋白是病情严重程度的标志,反映了炎症状态。非特异性营养不良和蛋白质能量营养不良患者的死亡率会升高(30天,90天,360天)
SGA(主观全面评估):包括病史和体检。表明:患有营养不良的患者包括体重知数<18.5kg/m2 ,或无论何时体重下降10%的患者,或在过去3个月中体重指数<20(<70岁)或<22(>70岁)。或者女性(男性)的无脂肪质量指数分别为<15(<17)kg/m2。后来背表型和预先定义的病因学所取代。临床虚弱评分:1(非常健康)到7(非常虚弱),主要适用于老年患者。
肌肉质量:营养不良和肌肉消耗通常发生在重症监护室住院期间,是由于分解代谢激素的作用,摄入和需求之间的不平衡,也是身体制动的结果。肌肉减少症被定义为肌肉损失和、或功能下降,在入住 ICU 的营养不良患者中很常见。研究表明:入院时肌肉质量较低的患者住院时间越长,死亡率较高。
美国胃肠外和肠内营养学会(ASPEN)/SCCM重症医学学会指南:根据NRS 2002或危重患者的营养风险对患者进行分类,以确定他们的营养方案。急性危重症相关营养不良的定义仍需进一步研究。
3. 每个在重症监护室停留超过48小时的危重患者都应被视为有营养不良的风险
因为他要么是从院外通过急诊室/手术室,要么从医院病房入院。他们中的一些人明显营养不良,原因是先前严重的食欲不振、体重减轻导致瘦体重的可变减少和/或多种合并症,他们通常会接受营养支持。所以营养干预需要仔细的规划。目标:最大限度地减少营养不良以及避免住院期间地过度喂养和营养并发症。现状:没有具体的ICU营养评分得到验证,现有的NRS 2002 和营养不良通用筛查工具评分不是专门为危重症患者设计的。基于年龄、APACHE II 和序惯性器官衰竭(SOFA)评分反应疾病严重程度、共病率、从医院到ICU入院的天数以及白细胞介素6水平评估:NOTRIC。最终的评分与死亡率有关,预期通过营养支持降低高营养评分(>5)的死亡率。
4. 对于能够进食的危重患者,口服饮食应优先于肠内营养或胃肠外营养。
如果不能口服,应在重症成人患者中进行早期肠内营养(48小时内),而不是推迟肠内营养
如果不能口服,应在重症成人患者中进行/开始早期肠内营养(48小时内),而不是早期肠外营养
如有口服和肠内营养禁忌症,应在三到七天内进行肠外营养
在严重营养不良患者出现肠内营养禁忌症的情况下,可以提供早期和进行肠外营养,而不是不提供营养。
为避免过量喂养,早期全肠内营养和肠外营养不得用于危重患者,但应在3至7天内开具处方。
备注:早期肠内营养能够减少感染并发症和住院的时间,而死亡率没有什么不同。
患者被确定处于高营养风险中(例如,NRS 2002>5)或严重营养不良,而EN不可行,则应慎重考虑开始低剂量PN,并与过量喂养和再喂养的风险相平衡,后者可能超过预期的益处。(ESICM 指南中定义了停用肠内营养的症状)
能量,途径,时机都有可能引起并发症的增加。
5. 应使用连续而非追加的肠内营养。
讨论:连续给药与单次给药相比腹泻显著减少。
药丸喂养给蛋白质的合成造成更大的刺激。
6. 胃肠内应作为启动肠内营养的标准方法
对于不能用促动力药解决的胃喂养不耐受患者,应使用幽门后喂养。
对于被认为有高误吸风险的患者,可以进行幽门后喂养,主要是空肠喂养
讨论:
胃肠道不支持,我们观察到接受幽门后喂养治疗的患者肺炎(11项研究)减少的趋势,其他死亡率、腹泻和时间均无差异。
具有极高误吸风险的患者可受益于早期幽门后肠内营养。对有高误吸风险的患者进行幽门后喂养。
吸入风险增加的患者可由多种因素确定,包括无法保护气道、机械通气、年龄> 70岁、意识水平降低、口腔护理差、护士与患者的比例不足、仰卧位、神经功能缺损、胃食管反流、离开重症监护室和使用间歇推注。
7. 在胃喂养不耐受的危重患者中,静脉注射红霉素应作为一线促动力治疗。
或者,静脉注射甲氧氯普胺或甲氧氯普胺和红霉素的组合可用作促动力疗法。
讨论:
促动力使用与更好的肠内喂养耐受性的趋势相关
72小时后,红霉素或其他促动力药的有效性降低到三分之一[109],应在三天后停止使用。
8. 如何定义能量消耗:患者入院前的营养状况:瘦、体重正常、超重或肥胖、入院前体重明显下降
在重症监护室入院前和/或在重症监护室住院的天数
内源性营养产生和自噬
患者在重症监护室住院期间的能量平衡
方式:在危重机械通气患者中,应使用间接量热法测定
如果量热法不可用,使用来自肺动脉导管的VO2(氧消耗)或来自呼吸机的VCO2(二氧化碳产生)将给出比预测方程更好的EE评估。
9. 如果使用间接能量法,等热量营养而不是低能量营养可以在急性疾病早期逐步实施
低能量营养(不超过EE的70%)应在急性疾病的早期给予。
在第三天之后,热量输送可以增加到80-100%的实测能量。
讨论:营养不良和营养过剩都是有害的,应该建立在观察性研究的基础上。内源性营养??
过少会消耗身体内的脂肪等,过多会造成什么损害呢?应该在测定的EE的70%-100%。
如果使用预测方程来估计能量需求,在重症监护室住院的第一周,低热量营养(低于估计需求的70%)应优先于等热量营养。
讨论:近 10 年来采用的是预热方程的方式。
10. 第一周不能耐受全剂量肠内营养的患者,应根据具体情况权衡开始肠外营养的安全性和益处。
在尝试了最大化肠内营养耐受性的所有策略之前,不应开始肠外营养。(肠外营养实施的时间仍然是存在争议的。)研究指出并发症的增多可能是前期营养过剩而不是后面采用了肠外的方式。
11. 在重病期间,每天可逐步输送1.3克/千克蛋白质剂量。
体育活动可以提高营养疗法的有益效果。
讨论:
提供给大多数重症监护室患者的蛋白质量少于损失。当蛋白质施用量大于1.3克/千克/天时,存活率显著提高,每1克蛋白质可增加1%的存活率。
12. 给予ICU患者的葡萄糖(PN)或碳水化合物(EN)的量不应超过5毫克/千克/分钟。
静脉注射脂肪乳剂的给药通常应该是PN的一部分。
静脉注射脂质(包括非营养脂质源)不应超过1.5 g脂质/kg/天,并应适应个体耐受性。
讨论:
过量服用会导致浪费、储存甚至中毒。
碳水化合物是产生能量的首选物。150克/天可能是安全的。
以前推荐必需脂肪酸的剂量为8克/天。施用显著量的碳水化合物和脂质会导致高血糖症和肝功能试验异常,而施用高脂肪会导致脂质超负荷,尤其是不饱和脂肪会损害肺功能和免疫抑制。
营养除了提供脂质,还会提供相应的能量,当然也会提供其他的一些东西。
13. 烧伤面积大于20%的患者,肠内营养开始后,应立即给予额外的谷氨酰胺(GLN)肠内剂量(0.3-0.5 g/kg/d),持续10-15天。
除烧伤和创伤患者外,重症监护室患者不应给予额外的肠内GLN。
对于不稳定和复杂的重症监护室患者,尤其是那些患有肝和肾功能衰竭的患者,不得使用胃肠外GLN二肽。
讨论:
GLN在细胞和/或器官之间运输氮,并作为快速增殖细胞的代谢燃料。
14. 高剂量的富含欧米伽-3的欧洲配方奶粉不应通过丸药给药。
可以服用营养剂量的富含欧米伽-3脂肪酸的肠内营养。
不应该在常规基础上给予高剂量的富含omega-3的肠内配方奶粉。
胃肠外脂肪乳剂富含二十碳五烯酸(鱼油剂量0.1-0.2克/千克/天),可用于接受胃肠外营养的患者。
微量营养素,即微量元素和维生素,有许多功能,它们通常结合使用:它们对碳水化合物、蛋白质和脂质的代谢(即营养)、免疫和抗氧化防御、
内分泌功能以及DNA合成、基因修复和细胞信号传导至关重要。目前的建议仅限于营养和抗氧化方面。
15. 为了使营养代谢,微量营养素(即微量元素和维生素)应每天与PN一起提供。
抗氧化剂作为高剂量单一疗法,在没有证明缺乏的情况下不应使用。
16. 对于测得的低血浆水平(25-羟基维生素D < 12.5纳克/毫升,或50纳摩尔/升)的危重患者,可补充维生素D3
对于血浆中25-羟基维生素D水平较低(小于12.5纳克/毫升或50毫摩尔/升)的危重患者,可在入院后一周内给予单剂量高剂量维生素D3 (500,000国际单位)。
17. 特殊治疗
EN应该延迟 1. 如果休克未得到控制,且未达到血液动力学和组织灌注目标,则可在用液体和血管升压剂/抗营养剂控制休克后立即开始低剂量肠内营养,同时对肠缺血的迹象保持警惕; 2. 在无控制的危及生命的低氧血症、高碳酸血症或酸中毒的情况下,而在稳定低氧血症、代偿性或容许性高碳酸血症和酸中毒的患者中可以开始肠内营养; 3. 患有活动性上消化道出血的患者,而当出血停止且未观察到再出血迹象时,可开始肠内营养; 4. 明显肠缺血的患者; 5. 对于高输出肠瘘患者,如果无法在瘘管远端获得可靠的进食通道; 6. 腹腔间隔室综合征患者; 7. 如果胃抽吸量高于500毫升/6小时
应给予低剂量肠内营养 1. 在接受治疗性低温并在复温后增加剂量的患者中 2. 对于无腹腔间隔室综合征的腹内高压患者,当腹内压力值在肠内营养下进一步增加时,应考虑暂时减少或停止肠内营养; 3. 在急性肝功能衰竭患者中,无论有无肝支持策略,急性、立即威胁生命的代谢紊乱都得到控制,与脑病的分级无关。
应进行早期肠内营养 1. 在接受ECMO治疗的病人中 2. 在创伤性脑损伤患者中 3. 中风患者(缺血性或出血性) 4. 在脊髓损伤患者中 5. 在重症急性胰腺炎患者中 6. 胃肠道手术后的病人 7. 腹主动脉手术后的病人 8. 在腹部外伤患者中,当胃肠道的连续性被确认/恢复时 9. 在接受神经肌肉阻断剂的患者中 10. 在俯卧位的患者中 11. 腹部开放的病人 12.不考虑肠鸣音的存在,除非怀疑腹泻患者存在肠缺血或梗阻
想法:对于划分,可以分前两天,然后后面用药。
18. 不包括在 ESICM 中的情况。
对于未插管但通过口服饮食未达到能量目标的患者,应首先考虑口服营养补充剂,然后考虑肠内营养。
对于有吞咽困难的非插管患者,可以考虑食用质地适宜的食物。如果吞咽被证明不安全,应进行肠内营养。
对于吞咽困难和误吸风险非常高的非插管患者,可以进行幽门后肠内营养,或者,如果不可能,在吞咽训练期间进行临时肠内营养,并移除鼻肠内管。
虚弱的病人
可以在入院时以及在重症监护室住院期间被诊断出来。虚弱是一种临床综合征,其中出现以下3个或更多标准:1 .无意减肥,2。自述疲惫,3。弱点(按握力),4。慢走速度和
5。低体力活动。
没有在重症监护室住院期间诊断虚弱的具体标准。食欲和营养摄入不足可能是显而易见的。虚弱在老年人群中更常见(80岁以上的患者中有50%),并且与死亡率增加有关。
它不同于营养不良,正如一项评估营养不良和虚弱的系统综述所表明的那样:在10项研究的5447名老年患者中,2.3%营养不良(根据迷你营养评估),19.1%虚弱。68%的营养不良者身体虚弱。
一个ESPEN专家工作组建议营养不良或因患有急性或慢性疾病而有营养不良风险的老年人每天摄入1.2-1.5克蛋白质,患有严重疾病或损伤的人甚至摄入大量蛋白质
19. 在患有败血症的成年危重患者中,血流动力学稳定后,脓毒症患者应使用早期和进行性肠内营养。如果禁用,则应使用渐进PN替换或补充EN。
重症监护室营养治疗监测的主要目标是: a)确保按照关于能量、蛋白质和微量营养素目标的规定计划和提供最佳营养支持; b)预防或检测任何可能的并发症; c)监测对营养支持的反应并检测再次给与营养支持; d)检测处于风险中的患者类别的微量营养素缺乏症。
测量的指标: 1. 血糖应首先测量(在ICU入院后或人工营养开始后),一般至少每4小时测量一次,前两天测量一次。 2. 当葡萄糖水平超过10毫摩尔/升时,应给予胰岛素 3. 电解质(钾、镁、磷酸盐)应在第一周每天至少测量一次。 4. 对于再次喂食低磷血症(< 0.65毫摩尔/升或一滴> 0.16毫摩尔/升)的患者,应每天测量电解质23次,并在需要时进行补充 5. 再喂养低磷血症患者中,能量供应应限制48小时,然后逐渐增加。