一、氮
元素名称:氮。
元素符号:N。
原子序数:7。
在周期表中的位置:第二周期ⅤA族。
电子排布式:[He]2s22p3。
1.氮气
化学式:N2。
分类:非金属单质。
物理性质:无色无味气体,密度略小于空气,难溶于水,沸点:-196℃。
化学性质:
①非金属单质的通性:
与金属单质反应:
与锂单质反应:6Li + N2 =常温/点燃/△= 2Li3N。
与钠单质反应:6Na + N2 =常温/点燃/△= 2Na3N。
与钾单质反应:6K + N2 =常温/点燃/△= 2K3N。
与镁单质反应:3Mg + N2 =点燃/△= Mg3N2。
与钙单质反应:3Ca + N2 =点燃/△= 2Ca3N2。
与铝单质反应:2Al + N2 =高温= 2AlN。
与非金属单质反应:
与氟气反应:N2 + 3F2 =放电/△= 2NF3。N2 + 4F2 =一定条件= [NF4]+[NF4]-。
与氧气反应:N2 + O2 =放电/高温= 2NO。
与氯气反应:N2 + 3Cl2 =放电/高温= 2NCl3。
与溴单质反应:N2 + 3Br2 =放电/高温= 2NBr3。
与碘单质反应:N2 + 3I2 =放电/高温= 2NI3。
与氢气反应:N2 + 3H2 ⇌高温高压⇌催化剂⇌ 2NH3。
与硼单质反应:2B + N2 =高温= 2BN。
与硅单质反应:3Si + 2N2 =高温= Si3N4。
制备:
工业制氮气:分离液态空气。
实验室制氮气(加热饱和氯化铵和亚硝酸钠的混合溶液):NH4Cl + NaNO2 =△= NaCl + N2↑ + 2H2O。
2.一氧化氮
化学式:NO(1个σ键、1个π键、1个二中心三电子π键)。
结构式: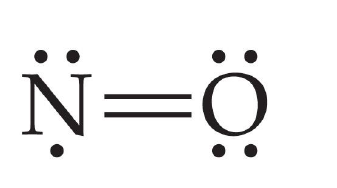 。
。
分类:不成盐氧化物。
物理性质:无色无味有毒气体,密度略大于空气,难溶于水。
化学性质:
①还原性:HNO2 + H+ = NO+ + H2O。
与氟气反应:2NO + F2 = 2NOF。
与氧气反应:2NO + O2 = 2NO2。
与臭氧反应:NO + O3 = NO2 + O2。
与氯气反应:2NO + Cl2 = 2NOCl。
与溴单质反应:2NO + Br2 = 2NOBr。
与碘单质反应:2NO + I2 = 2NOI。
与二氧化碳反应:NO + CO2 =高温= NO2 + CO。
与碘单质反应:2NO + 3I2 + 4H2O = 2NO3- + 6I- + 8H+。
②氧化性:
与氢气反应:2NO + 2H2 =高温= N2 + 2H2O。
与白磷反应:10NO + P4 =高温= 5N2 + P4O10。
③归中反应:NO + NO2 + 2NaOH = 2NaNO2 + H2O。
③二聚反应:2NO ⇌ N2O2。
④配位性:
棕色环反应:Fe2+ + NO = [Fe(NO)]2+。
制备:
工业制一氧化氮:4NH3 + 5O2 =Pt-Rh=△= 4NO + 6H2O。
实验室制一氧化氮:3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O。
3.一氧化二氮
俗名:笑气。
化学式:N2O(中心N:sp杂化,端基N:不杂化,2个σ键、2个Π34)。
结构式:

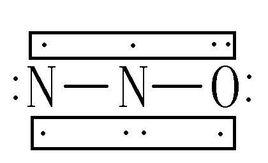 。
。
等电子体:CO2。
分类:不成盐氧化物。
物理性质:无色具有甜味有毒气体,密度大于空气,微溶于水。
化学性质:
①还原性:
与氨基钠反应:N2O + NaNH2 = NaN3 + H2O。
②氧化性。
4.一氧化四氮(叠氮化亚硝酰)
化学式:N4O。
分类:不成盐氧化物。
5.二氧化氮
化学式:NO2(N:sp2杂化,2个σ键,1个Π34)。
结构式: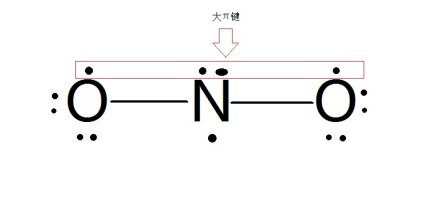 。
。
分类:不成盐氧化物。
物理性质:红棕色具有刺激性气味有毒气体,密度大于空气,易溶于水。
化学性质:
①还原性:
与臭氧反应:NO2 + O3 = NO3 + O2。
与高锰酸根离子反应:10NO2 + 2MnO4- + 2H2O = 2Mn2+ + 10NO3- + 4H+。
②氧化性:
与碳单质反应:2C + 2NO2 =点燃= 2CO2 + N2。
与硫单质反应:4S + 6NO2 =点燃= 4SO3 + 3N2。
与磷单质反应:8P + 10NO2 =点燃= 2P4O10 + 5N2。
与一氧化碳反应:NO2 + CO = NO + CO2。
与二氧化硫反应:NO2 + SO2 = NO + SO3。
与氯化氢反应:NO2 + 2HCl = NO + Cl2 + H2O。
与溴化氢反应:NO2 + 2HBr = NO + Br2 + H2O。
与碘化氢反应:NO2 + 2HI = NO + I2 + H2O。
与硫化氢反应:4NO2 + H2S = 4NO + SO3 + H2O。
③歧化反应:
与水反应:3NO2 + H2O = 2HNO3 + NO。
与碱反应:
与氢氧化钠反应:2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O。
④归中反应:NO + NO2 + 2NaOH = 2NaNO2 + H2O。
⑤二聚反应:2NO2 ⇌ N2O4。
用途:气室法制硫酸。
制备:
实验室制二氧化氮:Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑ + 2H2O。
6.二氧化二氮(一氧化氮二聚体)
化学式:N2O2。
分类:不成盐氧化物。
7.三氧化氮
化学式:NO3。
结构式: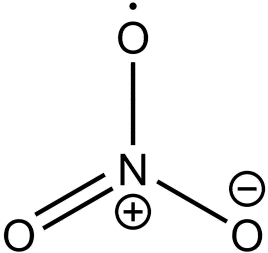 。
。
分类:不成盐氧化物。
制备:
五氧化二氮光解:N2O5 =光照= NO2 + NO3。
硝酸氯光解:2ClONO2 =光照= Cl2 + 2NO3。
8.三氧化二氮
化学式:N2O3。
结构式: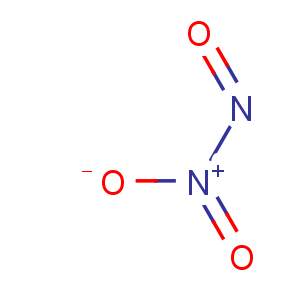 。
。
分类:酸性氧化物。
物理性质:红棕色具有刺激性气味有毒气体/深蓝色具有刺激性气味有毒液体,密度大于空气,易溶于水。
化学性质:
①酸性氧化物的通性:
与水反应:N2O3 + H2O = 2HNO3。
②不稳定性:
三氧化二氮光解:N2O3 =光照= NO + NO2。
9.四氧化二氮
化学式:N2O4(2个N:sp2杂化,5个σ键,1个π68)。
结构式: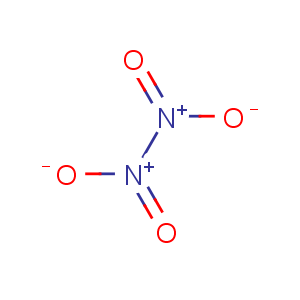 。
。
分类:不成盐氧化物。
物理性质:无色具有刺激性气味有毒气体,密度大于空气,易溶于水。
10.五氧化二氮
化学式:N2O5。
结构式: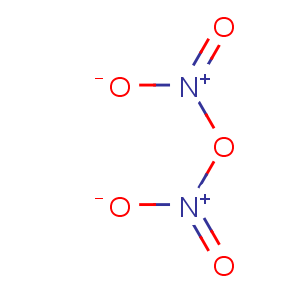 。
。
分类:酸性氧化物。
物理性质:无色具有刺激性气味柱状有毒固体,密度大于水,易溶于水。
化学性质:
①酸性氧化物的通性:
与水反应:N2O5 + H2O = 2HNO3。
②不稳定性:
五氧化二氮光解:N2O5 =光照= NO2 + NO3。
11.六氧化四氮(三硝基胺)
化学式:N(NO2)3。
分类:不成盐氧化物。
化学性质:
①还原性:
与氧气反应:N(NO2)3 + O2 =点燃= 4NO2。
与过氧化氢反应:N(NO2)3 + 2H2O2 = 4NO2 + 2H2O。
12.氨气
俗名:氨水(氨气的水溶液)。
化学式:NH3。
分类:一元弱碱。
物理性质:无色具有刺激性气味有毒气体,密度小于空气,极易溶于水,易液化。
化学性质:
①碱性:
电离方程式(与水反应):NH3 + H2O ⇌ NH3·H2O ⇌ NH4+ + OH-。
与酸反应:NH3 + H+ = NH4+。
与稀盐酸反应:NH3 + HCl = NH4Cl。
与稀硫酸反应:2NH3 + H2SO4 = (NH4)2SO4。
与稀硝酸反应:NH3 + HNO3 = NH4NO3。
②还原性:
与氟气反应:2NH3(少量) + 3F2 = N2 + 6HF。8NH3(足量) + 3F2 = N2 + 6NH4F。
与氧气反应:4NH3 + 3O2 =点燃= 2N2 + 6H2O。4NH3 + 5O2 =Pt-Rh=△= 4NO + 6H2O。
与氯气反应:2NH3(少量) + 3Cl2 = N2 + 6HCl。8NH3(足量) + 3Cl2 = N2 + 6NH4Cl。
与溴单质反应:2NH3(少量) + 3Br2 = N2 + 6HBr。8NH3(足量) + 3Br2 = N2 + 6NH4Br。
与碘单质反应:2NH3(少量) + 3I2 = N2 + 6HI。8NH3(足量) + 3I2 = N2 + 6NH4I。
与氧化铜反应:2NH3 + 3CuO =△= 3Cu + N2 + 3H2O。
与过氧化氢反应:2NH3 + 3H2O2 = N2 + 6H2O。
与高锰酸根离子反应:10NH3 + 6MnO4- = 6Mn2+ + 5N2 + 18OH- + 6H2O。
与次氯酸根离子反应:2NH3 + ClO- = Cl- + N2H4 + H2O。
③配位性:
与银离子反应:Ag+ + 2NH3 = [Ag(NH3)2]+。
与铜离子反应:Cu2+ + 4NH3 = [Cu(NH3)4]2+。
制备:
工业制氨气:N2 + 3H2 ⇌高温高压⇌催化剂⇌ 2NH3。
实验室制氨气:
2NH4Cl + Ca(OH)2 =△= CaCl2 + 2NH3↑ + 2H2O。
NH3·H2O =△= NH3↑ + H2O。
CaO + NH3·H2O = Ca(OH)2 + NH3↑。
13.液氨
化学式:NH3。
化学性质:
①自偶电离/自耦电离:2NH3 ⇌ NH4+ + NH2-。
②复分解反应:
NH4+ + NH2- = 2NH3。
Zn2+ + 2NH2- = Zn(NH2)2。Zn(NH2)2 + 2NH2- = [Zn(NH2)4]2-。
Ag+ + NH2- = AgNH2。
③氨解反应:
光气氨解:COCl2 + 4NH3 = CO(NH2)2 + 2NH4Cl。
五氯化磷氨解:PCl5 + 8NH3 = PN(NH2)2 + 5NH4Cl。
氯化砜氨解:SO2Cl2 + 4NH3 = SO2(NH2)2 + 2NH4Cl。
氯化汞氨解:HgCl2 + 2NH3 = Hg(NH2)Cl + NH4Cl。
④还原性:
与碱金属反应:2M + 2NH3(l) = 2MNH2 + H2↑。
与碱土金属反应:M + 2NH3(l) = M(NH2)2 + H2↑。
14.一水合氨
化学式:NH3·H2O。
分类:一元弱碱。
化学性质:
①碱性:
电离方程式:NH3·H2O ⇌ NH4+ + OH-。
与非金属氧化物反应:
与二氧化碳反应:CO2(少量) + 2NH3·H2O = 2NH4+ + CO32- + H2O。CO2(足量) + NH3·H2O = NH4+ + HCO3-。
与二氧化硫反应:SO2(少量) + 2NH3·H2O = 2NH4+ + SO32- + H2O。SO2(足量) + NH3·H2O = NH4+ + HSO3-。
与酸反应:
与稀盐酸反应:NH3·H2O + HCl = NH4Cl + H2O。
与稀硫酸反应:2NH3·H2O + H2SO4 = (NH4)2SO4 + 2H2O。
与稀硝酸反应:NH3·H2O + HNO3 = NH4NO3 + H2O。
②不稳定性:
一水合氨受热分解:NH3·H2O =△= NH3↑ + H2O。
15.铵盐
化学性质:
①盐的通性:
与碱反应:NH4+ + OH- = NH3·H2O。NH4+ + OH- =△= NH3↑ + H2O。
②水解性:NH4+ + H2O ⇌ NH3·H2O + H+。
③热不稳定性:
氯化铵受热分解:NH4Cl =△= NH3↑ + HCl↑。
硫酸铵受热分解:(NH4)2SO4 =△= 2NH3↑ + H2SO4。
硫酸氢铵受热分解:NH4HSO4 =△= NH3↑ + H2SO4。
硝酸铵受热分解:2NH4NO3 =△= 2N2↑ + O2↑ + 4H2O。NH4NO3 =△= N2O↑ + 2H2O。
磷酸铵受热分解:(NH4)3PO4 =△= 3NH3↑ + H3PO4。
磷酸一氢铵受热分解:(NH4)2HPO4 =△= 2NH3↑ + H3PO4。
磷酸二氢铵受热分解:NH4H2PO4 =△= NH3↑ + H3PO4。
碳酸铵受热分解:(NH4)2CO3 =△= 2NH3↑ + H2O + CO2↑。
碳酸氢铵受热分解:NH4HCO3 =△= NH3↑ + H2O + CO2↑。
亚硫酸铵受热分解:(NH4)2SO3 =△= 2NH3↑ + H2O + SO2↑。
亚硫酸氢铵受热分解:NH4HSO3 =△= NH3↑ + H2O + SO2↑。
重铬酸铵受热分解:(NH4)2Cr2O7 =△= N2↑ + Cr2O3 + 4H2O。
16.肼/联氨
化学式:N2H4(2个N:sp3杂化)。
分类:二元弱碱。
物理性质:无色具有刺激性气味有毒油状液体,密度大于水,极易溶于水。
化学性质:
①碱性:
电离方程式(与水反应):N2H4 + H2O ⇌ N2H4·H2O ⇌ N2H5+ + OH-。N2H5+ + H2O ⇌ N2H62+ + OH-。
与酸反应:N2H4 + H+ = N2H5+。N2H5+ + H+ = N2H62+。
与稀盐酸反应:N2H4 + HCl(少量) = N2H5Cl。N2H4 + 2HCl(足量) = N2H6Cl2。
与稀硫酸反应:2N2H4 + H2SO4(少量) = (N2H5)2SO4。2N2H4 + 2H2SO4(足量) = (N2H6)2SO4。
②还原性:
与氟气反应:N2H4 + 2F2 = N2 + 4HF。
与氧气反应:N2H4 + O2 = N2 + 2H2O。
与氯气反应:N2H4 + 2Cl2 = N2 + 4HCl。
与溴单质反应:N2H4 + 2Br2 = N2↑ + 4HBr。
与碘单质反应:N2H4 + 2I2 = N2↑ + 4HI。
与氧化铜反应:N2H4 + 2CuO =△= 2Cu + N2↑ + 2H2O。
与三氧化二铁反应:6Fe2O3 + N2H4 = 4Fe3O4 + N2↑ + 2H2O。
与过氧化氢反应:N2H4 + 2H2O2 = N2↑ + 4H2O。
与二氧化氮反应:2N2H4 + 2NO2 = 3N2 + 4H2O。
与四氧化二氮反应:2N2H4 + N2O4 = 3N2 + 4H2O。
与亚硝酸反应:N2H4 + HNO2 = HN3 + 2H2O。
与银离子反应:N2H4 + 4Ag+ = 4Ag + N2↑ + 4H+。
与高锰酸根离子反应:5N2H4 + 4MnO4- + 12H+ = 5N2↑ + 4Mn2+ + 16H2O。
③氧化性。
④配位性。
用途:
①高能燃料。
②吸收锅炉水中的氧气。
③锅炉防锈。
17.羟胺
化学式:NH2OH。
构型:顺式(羟基氢与氨基氢同侧)、反式(羟基氢与氨基氢异侧)。
分类:一元弱碱。
物理性质:白色具有刺激性气味有毒固体,密度大于水,极易溶于水。
化学性质:
①碱性:NH3 > NH2OH。
电离方程式(与水反应):NH2OH + H2O ⇌ NH3OH+ + OH-。
与酸反应:NH2OH + H+ = NH3OH+。
与稀盐酸反应:NH2OH + HCl = NH3OHCl。
与稀硫酸反应:2NH2OH + H2SO4 = (NH3OH)2SO4。
②还原性:
与氟气反应:2NH2OH + F2 = N2 + 2HF + 2H2O。
与氯气反应:2NH2OH + Cl2 = N2 + 2HCl + 2H2O。
与溴单质反应:2NH2OH + Br2 = N2↑ + 2HBr + 2H2O。
与碘单质反应:2NH2OH + I2 = N2↑ + 2HI + 2H2O。
与硝酸反应:NH2OH + HNO3 = 2NO↑ + 2H2O。
与银离子反应:2NH2OH + 2Ag+ = 2Ag + N2↑ + 2H2O + 2H+。2NH2OH + 4Ag+ = 4Ag + N2O↑ + H2O + 4H+。
③氧化性。
④配位性:
与高钴离子反应:Co3+ + 6NH2OH = [Co(NH2OH)6]3+。
与锌离子反应:Zn2+ + 4NH2OH = [Zn(ONH3)4]2+。
18.叠氮酸
化学式:HN3(α-N:sp2杂化,β-N:sp杂化,γ-N:不杂化,3个σ键,1个Π34)。
结构式: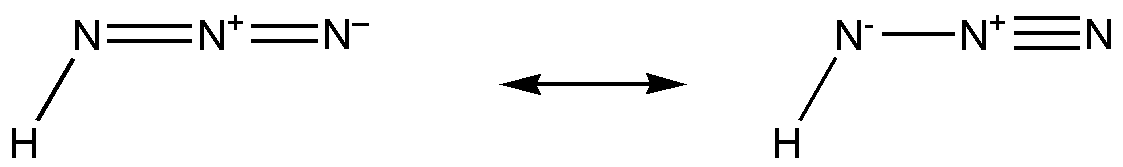 。
。
分类:一元弱酸。
物理性质:无色具有刺激性气味油状有毒液体,密度大于水,能与水以任意比例互溶,易爆炸。
化学性质:
①酸性:
电离方程式:HN3 ⇌ H+ + N3-。
与金属单质反应:
与锌单质反应:Zn + 2HN3 = Zn(N3)2 + H2↑。
叠氮酸、浓盐酸的混合物能溶解铂、金。
与碱反应:HN3 + OH- = N3- + H2O。
与氢氧化钠反应:HN3 + NaOH = NaN3 + H2O。
②氧化性:
Cu + 3HN3 = Cu(N3)2 + NH3↑ + N2↑。
③歧化反应:HN3 + H2O =Pt= NH2OH + N2↑。
④不稳定性:2HN3 =撞击/△= H2↑ + 3N2↑。
制备:
亚硝酸氧化联氨/肼:N2H4 + HNO2 = HN3 + 2H2O。
叠氮化钠与硫酸反应:NaN3 + H2SO4 = NaHSO4 + HN3。
19.叠氮酸盐
化学性质:
①盐的通性:
与酸反应:H+ + N3- = HN3。
与盐反应:
与银离子反应:Ag+ + N3- = AgN3↓(白色沉淀)。
②不稳定性:
叠氮化钠分解:2NaN3 =△/撞击= 2Na + 3N2↑。
叠氮化铜分解:Cu(N3)2 =△/撞击= Cu + 3N2↑。
叠氮化银分解:2AgN3 =△/撞击= 2Ag + 3N2↑。
叠氮化汞分解:Hg(N3)2 =△/撞击= Hg + 3N2↑。
叠氮化铊分解:2TlN3 =△/撞击= 2Tl + 3N2↑。
叠氮化铅分解:Pb(N3)2 =△/撞击= Pb + 3N2↑。
制备:
一氧化二氮与氨基钠反应:N2O + NaNH2 = NaN3 + H2O。
用途:
①提纯金属。
②汽车安全气囊填充物。
19.亚硝酸
化学式:HNO2(N:sp2杂化,3个σ键,1个π键)。
结构式: 。
。
分类:一元弱酸。
构型:顺式(羟基氢与端基氧同侧)、反式(羟基氢与端基氧异侧)。稳定性:反式 > 顺式。
物理性质:亮蓝色具有刺激性气味有毒液体,密度大于水,能与水以任意比例互溶。
化学性质:
①酸性:
电离方程式:HNO2 ⇌ H+ + NO2-。
与碱反应:HNO2 + OH- = NO2- + H2O。
与氢氧化钠反应:HNO2 + NaOH = NaNO2 + H2O。
②氧化性。
③还原性。
④不稳定性:2HNO3 = N2O3 + H2O。2HNO3 = NO↑ + NO2↑ + H2O。3HNO2 = HNO3 + 2NO↑ + H2O。
制备:
一氧化氮、二氧化氮与水反应:NO + NO2 + H2O = 2HNO2。
亚硝酸钠与硫酸反应:NaNO2 + H2SO4 = NaHSO4 + HNO2。
20.亚硝酸盐
化学性质:
①盐的通性:
与酸反应:H+ + NO2- = HNO2。
与盐反应:Ag+ + NO2- = AgNO2↓(黄色沉淀)。
②氧化性:
与铝单质反应:2Al + NO2- + OH- + H2O = 2AlO2- + NH3↑。
与碘离子反应:2NO2- + 2I- + 4H+ = I2 + 2NO↑ + 2H2O。
③还原性:
与氧气反应:2NO2- + O2 = 2NO3-。
与氯气反应:Cl2 + NO2- + H2O = 2Cl- + NO3- + 2H+。
与溴单质反应:Br2 + NO2- + H2O = 2Br- + NO3- + 2H+。
与碘单质反应:I2 + NO2- + H2O = 2I- + NO3- + 2H+。
与高锰酸根离子反应:5NO2- + 2MnO4- + 6H+ = 2Mn2+ + 5NO3- + 3H2O。
④水解性:NO2- + H2O ⇌ HNO2 + OH-。
⑤配位性:
与高钴离子反应:Co3+ + 6NO2- = [Co(NO2)6]3-。
21.硝酸
发烟硝酸:溶质质量分数≥95%的硝酸。
王水:1体积浓硝酸、3体积浓盐酸的混合物。
化学式:HNO3(N:sp2杂化,4个σ键,1个Π34)。
结构式: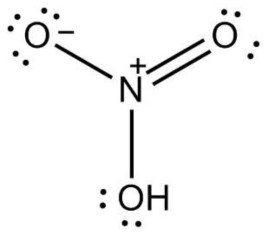 。
。
分类:一元强酸。
物理性质:无色具有刺激性气味有毒液体,密度大于水,能与水以任意比例互溶。
化学性质:
①酸性:
电离方程式:HNO3 = H+ + NO3-。
与金属单质反应:
与铝单质反应:Al + 4HNO3(稀) = Al(NO3)3 + NO↑ + 2H2O。
与锌单质反应:Zn + 4HNO3(浓) = Zn(NO3)2 + 2NO2↑ + 2H2O。3Zn + 8HNO3(稀) = 3Zn(NO3)2 + 2NO↑ + 4H2O。
与铁单质反应:Fe(少量) + 4HNO3(稀) = Fe(NO3)3 + NO↑ + 2H2O。3Fe(足量) + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑ + 4H2O。
与铜单质反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑ + 2H2O。3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O。
铝、铁、铬遇冷的浓硝酸发生钝化。
与碱反应:H+ + OH- = H2O。
与氢氧化钠反应:HNO3 + NaOH = NaNO3 + H2O。
②氧化性:
与碳单质反应:C + 4HNO3(浓) =△= CO2↑ + 4NO2↑ + 2H2O。
与磷单质反应:P + 5HNO3(浓) =△= H3PO4 + 5NO2↑ + H2O。
与砷单质反应:As + 5HNO3(浓) =△= H3AsO4 + 5NO2↑ + H2O。
与硫单质反应:S + 6HNO3(浓) =△= H2SO4 + 6NO2↑ + 2H2O。
与碘单质反应:I2 + 10HNO3(浓) =△= 2HIO3 + 10NO2↑ + 4H2O。
王水与铂单质反应:3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO↑ + 4H2O。
王水与金单质反应:Au + HNO3 + 4HCl = H[AuCl4] + NO↑ + 2H2O。
③不稳定性:
硝酸光解/受热分解:4HNO3 =光照/△= 4NO2↑ + O2↑ + 2H2O。
制备:
工业制硝酸:4NH3 + 5O2 =Pt-Rh=△= 4NO + 6H2O。2NO + O2 = 2NO2。3NO2 + H2O = 2HNO3 + NO。
实验室制硝酸:NaNO3 + H2SO4(浓) =△= NaHSO4 + HNO3↑。
22.硝酸盐
化学性质:
①盐的通性。
②热不稳定性:
硝酸钾受热分解:2KNO3 =△= 2KNO2 + O2↑。
硝酸钙受热分解:Ca(NO3)2 =△= Ca(NO2)2 + O2↑。
硝酸钠受热分解:2NaNO3 =△= 2NaNO2 + O2↑。
硝酸镁受热分解:2Mg(NO3)2 =△= 2MgO + 2NO2↑ + O2↑。
硝酸铝受热分解:4Al(NO3)3 =△= 2Al2O3 + 12NO2↑ + 3O2↑。
硝酸铁受热分解:4Fe(NO3)3 =△= 2Fe2O3 + 12NO2↑ + 3O2↑。
硝酸铅受热分解:2Pb(NO3)2 =△= 2PbO + 4NO2↑ + O2↑。
硝酸铜受热分解:2Cu(NO3)2 =△= 2CuO + 4NO2↑ + O2↑。
硝酸亚汞受热分解:Hg2(NO3)2 =△= 2Hg + 2NO2↑ + O2↑。
硝酸银受热分解:2AgNO3 =△= 2Ag + 2NO2↑ + O2↑。
硝酸铵受热分解:2NH4NO3 =△= 2N2↑ + O2↑ + 4H2O。NH4NO3 =△= N2O↑ + 2H2O。