标准书: YY/T 0664-2020 医疗器械软件 软件生存周期过程 - 道客巴巴 (doc88.com)
国家药监局关于发布34项医疗器械行业标准的公告(2020年第108号)
第10项为“YYT0664—2020”标准已于2020年9月27日发布,将于2021年9月1日实施。
YY/T0664-2020标准的发展历程
■国内初版YY/T0664-2008 idt IEC62304:2006
■国内新版YY/T0664-2020 mod IEC62304:2015
●2006—2008 2年
●2015—2020 5年
名称: MEDICAL DEVICE SOF TWARE- SOF TWARE LIFE CYCLE PROCESSES
现行版本:|EC62304:2006+EC62304:2006AMD1:2015 (EC6230411版,2015-06)
涉及YYT0664标准的医疗器械软件相关的法规
■医疗器械软件注册技术审查指导原则(通告2015年50号)
■医疗器械生产质量管理规范附录—独立软件(通告2019年第43号)
■各地方局法规:如,北京医疗软件产品技术审评规范(2016年修订)
■YY/T 0664标准在其它注册技术审査指导原则中的引用情况
●麻醉机注册技术审査指导原则征求意见稿)(2018.10.12)(直接引用)
●医学图像存储传输软件(PACS)注册技术审查指导原则(2016.02.26)(直接引用)
●持续葡萄糖监测系统注册技术审查指导原则(2018.3.16)(虽未直接引用但要求执行通告2015年50号,且有在安全分级的前提下进行软件研究的要求)
■医疗器械软件注册技术审查指导原则(通告2015年50号)
基本原则
风险管理:YY/T0316—2016:idt ISO 14971标准
质量管理:YY/T0287—2017:idt ISO 13485标准
软件工醒:ISO/IEC 12207:2008 Systems and software engineering - Software Life Cycle Progress
YY/0664—2020:idt IEC 62304标准,将三者结合后的结果。
软件描述文档
软件描述文档基于YY/T 0664《医疗器械软件软件 软件生存周期过程》子以制定,用于自主开发医疗器械软件的产品注册。
安全性级别
明确软件安全性级别(A级、B级、C级),详述确定理由
法规并没有直接描述分级方法,而是引用标准YY/T 0664
生存周期
A级提供软件开发生存周期计划摘要,描述开发各阶段的划分情况和工作任务;
B级在A级基础上提供配置管理计划摘要和维护计划摘要,描述所用的工具和流程。
C级在B级基础上提供设让历史文档集索引表(DHF)
生存周期也可提交制造商软件生存周期过程文件或YY/T 0684《医疗器械软件软件生存周期过程》等过程标准的核查表,用于替换相应描述。----软件生存周期过程的输出
总结
●医疗器械(带软件组件)或医疗器械独立软件注册所需的描述文档等资料:
是软件生命周期过程的输出;(需要编制相关资料)
需要在YY/T 0664所规定的软件生命周期过程中产生。(需要建立流程,作为过程的输出)
根据软件的安全级别软件生命周期过程控制的严格程度不同。
1)根据YY/T 0664—2020建立软件生存周期过程;
2)严格执行所建过程
医疗器械生产质量管理规范附录—独立软件(通告2019年第43号)
发布日期:2019年7月5日
生效日期:2020年7月1日
独立软件:具有一个或多个医疗目的,无需医疗器械硬件即可完成自身预期目的,运行于通用计算平台的软件。
软件组件:具有一个或多个医疗目的,控制、驱动医疗器械硬件或运行于医用计算平台的软件。
法规对于各类医疗器械软件均适用(软件组件参照执行)
摘录
2.3.2 软件生存周期过程质量保证活动要求应当与软件安全性级别相适宜。软件安全性级别应当在采取风险控制措施之前,结合软件的预期用途、使用场景和核心功能进行综合判定,并仅可通过外部风险控制措施降低级别。
基于风险,YY/T 0664标准根据软件安全级别,为医疗器械软件规定了繁简不同的设计开发、维护流程。
标注的意义:YY/T 0664—2020是满足法规要求必不可少的因为YY/T 0664-2020为开发维护安全的医疗器械提供了途径
YY/T 0664—2020 与其他标准的关系
YY/T 0664—2020标准目录
前言
引言
1范围
2规范性引用文件
3术语和定义
4总要求
4.1质量管理体系
4.2风险管理
4.3软件的安全分级/级别
4.4遗留软件
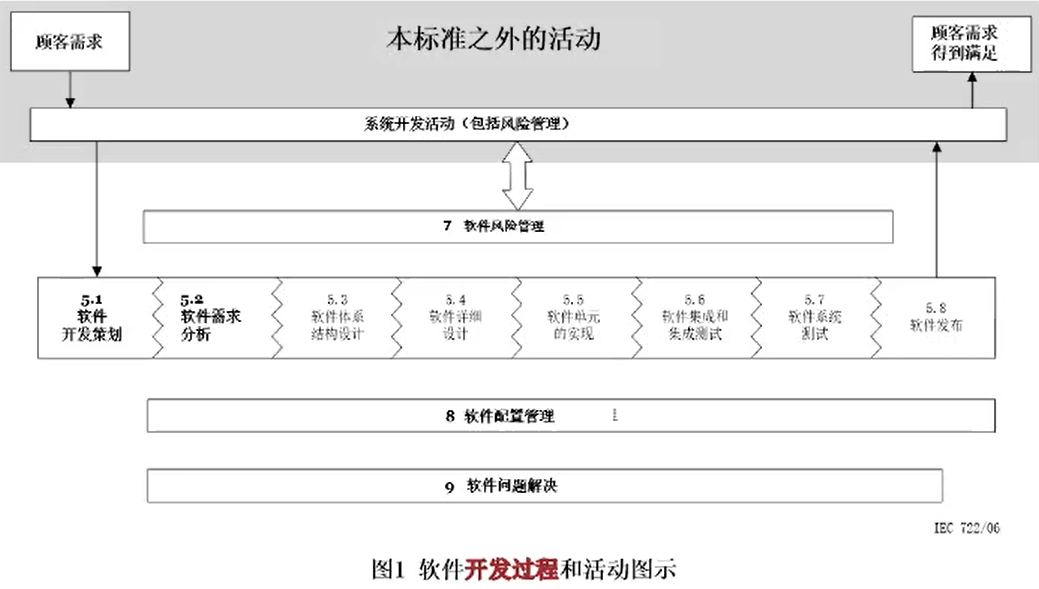
5软件开发过程
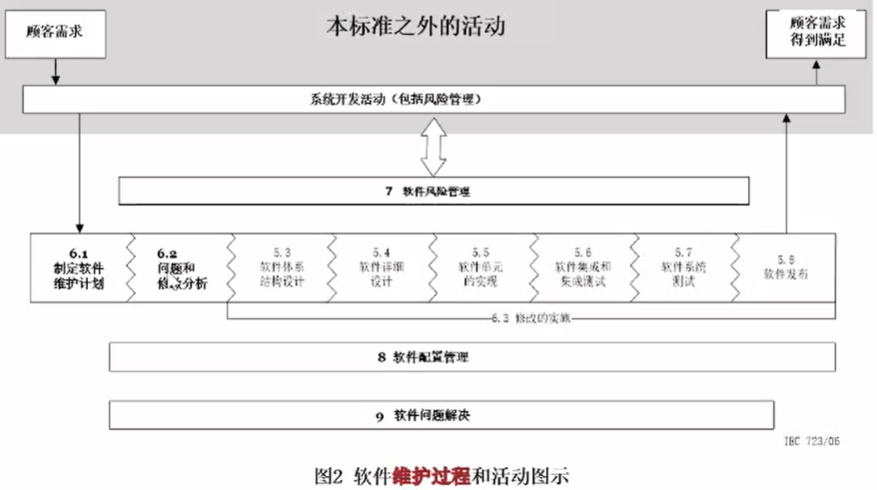
6软件维护过程
7软件风险管理过程
8软件配置管理过程
9软件问题解决过程
附录:A、B、C、D
lEC60601-1:对应GB9706.1医用电气设备第一部分:安全通用要求
lEC61010-1:对应GB4793.1测量、控制和实验室用电气设备的安全要求 第1部分通用要求(IEC61010-1:2001,|DT)
lEC/IS0 12207: Information technology-Software life cycle processes 对应国内标准GB/T 8566(信息技术一软件生存周期过程)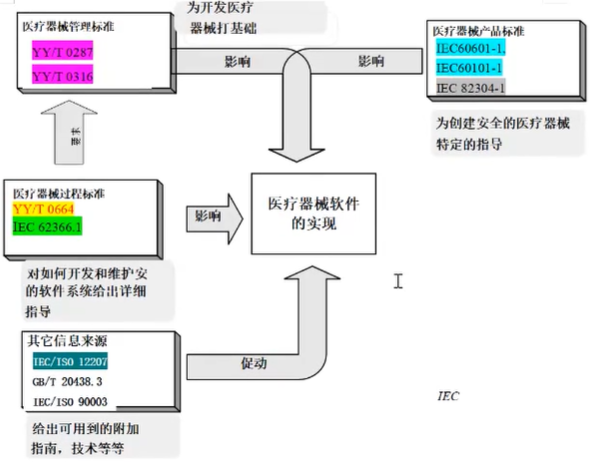
YY/T 0664与YY/T 0287和YY/T 0316的关系
■默认YY/T 0287(见标准4.1)与YY/T 0316(见标准4.2)管理体系是YY/T 0664标准运行的基础;
■把YY/T 0316作为规范性引用文件,将风险管理的要求纳入本标准要求
标准附录C1、c2中列明了YY/T 0664与YY/T 0287和YY/T 0316的关系
■软件的风险管理怎么做?
●按照YY/T 0316建立过程
●把第七草纳入(第7章软件的风险管理);
YY/T 1406.1 — 2016标准:YY/T 0316应用于医疗器械软件的指南
■风险管理需要要贯穿于整个开发、维护过程
YY/T 0664与IEC/ISO 12207的关系
YY/T 0664源于IEC/ISO 12207(信息技术软件生存周期过程)
YY/T 0664是IEC/ISO 12207经裁剪和其它处理的结果,原则:
●关注安全、医疗器械风险管理标准 YY/T 0316
●法规环境中有用的过程
●考虑到软件开发是涵盖于质量体系要求之中的;
●降低抽象程度以使其易于使用。
YY/T 0664 与IEC/ISO 12207区别:
●(YY/T 0664)医疗器械软件 vs (IEC/ISO 12207)所有软件
●降低安全要求对需求进行分级
说明:IEC/ISO 12207最新版本是IEC/ISO 12207:2017而YY/T 0664-2020与引文原版一样引用 IEC/ISO12207:2008的版本,因为2个版本结构变化很大,
YY/T 0664 - 2020标准与IEC60601(GB9706.1)的关系
GB9706.1 - 2020把YY/T 0664 - 2008作为规范性引用文件;
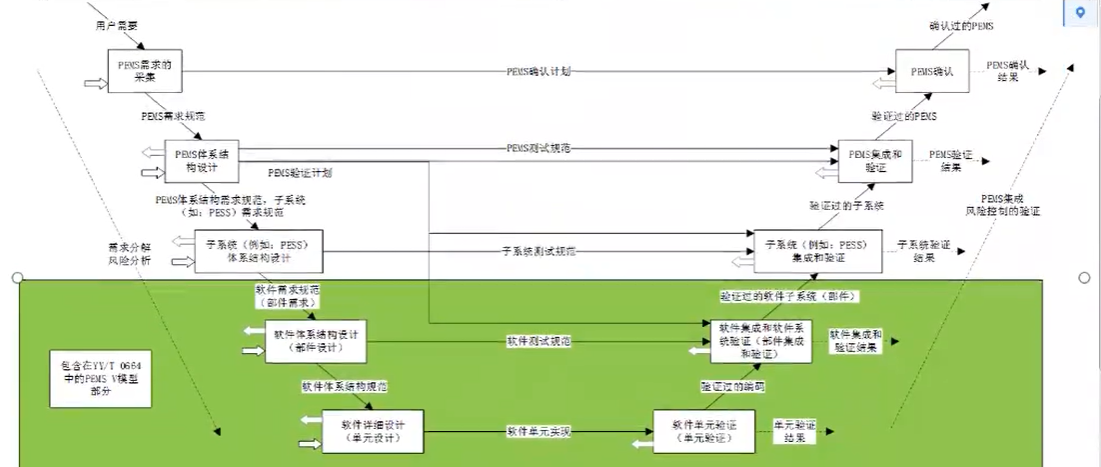
在软件是可编程医用电气系统(PEMS)的组成部分时,YY/T 0664的要求是GB9706.1-2020对可编程医用电气系统(PEMS)要求的补充;
GB9706.1-2020第14章要求符合YY/T 0664的一些部分(而非整个标准,因为GB9706.1-2020对生产后和维修无要求)
YY/T 0664有关软件开发过程和软件维护过程更详细。
YY/T 0664与GB9706.1-2020中可编程医用电气系统(PEMS)要求的关系
YY/T 0664 - 2020标准与IEC 61010(GB4793.1)
当ⅣD医疗器械有软件相关的风险时,其风险管理过程的实施遵循YY/T0316
此外,危险(源)识别后进行一下判断:
●有无安全相关标准能够覆盖危险(源)? 无
●医疗器械是否提供医疗数据? 是
●软件对医疗数据与影响吗? 是
●使用要求的程序验证数据吗? 无
应用YY/T0664-2020标准
YY/T 0664 - 2020标准的内容
1.1目的
本标准为医疗器械软件规定了生存周期要求。本标准中描述的一组过程、活动和任务,为医疗器械软件生存周期过程建立了共同的框架。
框架(过程 - 活动 - 任务)
1.2应用范围
“本标准适用于医疗器械软件的开发和维护。医疗器械软件包括本身是医疗器软件或是最终医疗器械的嵌入部分或组成部分的软件
适用于:独立软件,软件组件
“本标准不覆盖医疗器械的确认和最终发布,即使该医疗器械完全由软件组成。”
注3:在软件和医疗器械能够投入使用之前,需要在系统緞上进行确认和其他开发活动。本标准不覆盖这些系统级活动,可参见相关产品标准(如IEC60601-1[6],IEC82304-1[1]等)。
1.4符合性
“符合本标准意指按照软件安全级别,实施在本标准中确定的所有过程、活动和任务。
“通过对本标准所要求的所有文档(包括风险管理文档)的检查和对软件安全级别所要求的过程、活动和任务的评定来确定符合性。
2·规范性引用文件
YY/T 0316医疗器械风险管理对医疗器械的应用(YY/T 0316,ISO14971:2007 更正版,IDT)。”
3*.术语和定义
3.2反常 anomaly
与基于需求格说明设计文档和等的期望值的偏离或与某个人的感知或经验的任何条件的偏高。反常可能不限于在医疗器械软件或适用文件的评审、测试分析编译使用程中发现。
注:基于IEEE 1044:1993,定义3.1。
3.3体系结构 architecture
系统或组件的组织结构[lEEE610.12:1990]
3.15回归测试 regression testing
在对测试项或其运行环境修改后进行的测试,以确定是否出现回归失效
注1:回归测试用例集的充分性取决于所测试的测试项,以及对该测试项或其运行环境的修改。[ISO/IEC12207:2017,定义4.39]
ISO/IEC 90003:2014定义3.11:
用于确定对系统组件的更改没有对功能性、可靠性或性能产生不良影响,并且没有引入另外的缺陷所需的测试
3.24 软件开发生存周期模型 software development life cycle model
跨越软件从需求定义到发布这一时间段的概念结构,其:
识别包括在医疗器械软件开发中的过程、活动和任务
描述活动和任务之间的顺序和依赖关系
识别特定交付物完整性验证时机的里程碑
注:基于ISO12207:1995,定义3.11
■生存周期模型举例
瀑布:“单程”策略,也称为“瀑布
增量式开发模型
渐进
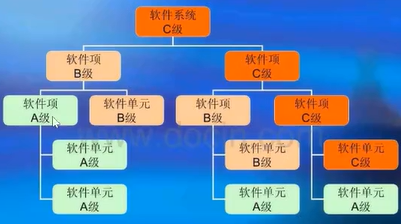
3.26 软件系统 software system
有组织的、经集成的软件项组合,以完成某个特定功能或一组功能。
3.27 软件单元 software unit
不可再分的软件项。
注:软件单元的粒度由制造商定义(见B.3)。
软件系统 - 软件项 - 软件单元间的关系:
3.28 未知来源软件(缩写SOUP) SOUP software of unknown provenance (acronym)
经开发且通常可得到,并且不是为包含到医疗器械内而开发的软件项(也称为成品软件),或以前开发的、不能得到其开发过程足够记录的软件项。
注:医疗器软件系统本身不舶声称是末知来源软件。
3.35 遗留软件 legacy software
合法地投放市场且至今仍在销售的医疗器椃软件,但其开发符合本标准现行版本的客观证据不充分。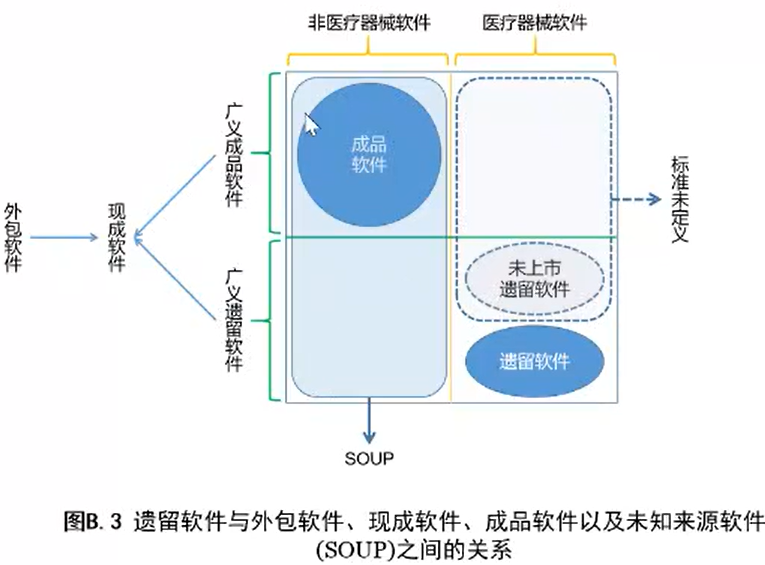
4.3* 软件的安全分级
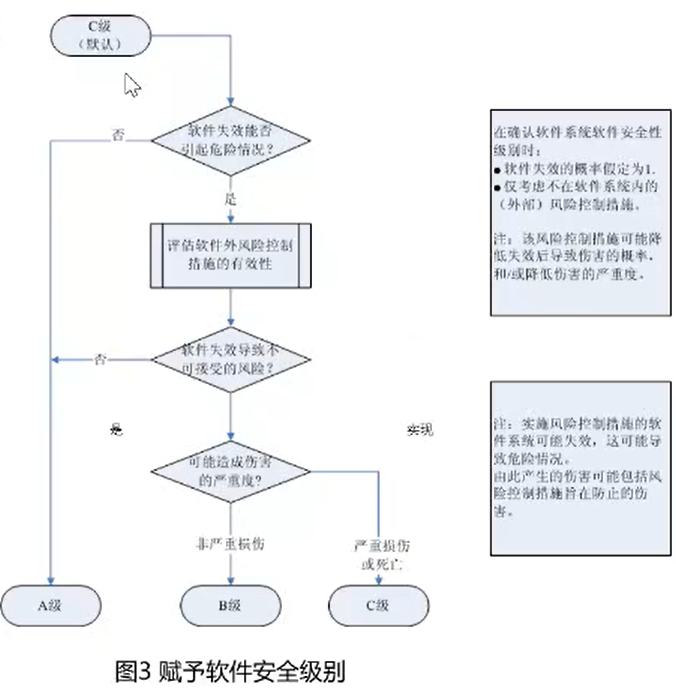
- 在软件分级前,均应应用C级要求;
- 在最不利的条件下分级;
- 根据促成的危险情况引发的对患者、操作者或其他人员伤害的风险,赋予软件安全级别(A、B或C)。
- 若最初分级为B、C的,可以采取软件外部风险控制措施,之后重新为其分级。
- 外部风险控制措施可以是软件、硬件、医疗管理程序等。
- 在风险管理文档中将赋予每个软件系统的软件安全级别形成文档。
■ 软件系统的划分

■ 安全相关软件项的隔离
单独分级;
说明理由、形成文件
对安全相软件项进行风险控制
确保安全相关软件项获得充分的资源,防范风险的发生。
■ 对A、B、C级的软件采用不同的生命周期过程进行设计开发、维护过程
■ 正文章节和条款后,以[..级]形式表示其适用的软件安全级别。
eg:5.1.1软件开发计划
[A、B、C级]
5.14软件开发标准、方法和工具的策划
C级
4.4*遗留软件
3.35遗留软件 legacy software
合法地投放市场且至今仍在销售的医疗器械软件,但其开发符合本标准现行版本的客观证据不充分。
本条款的作用
■为遗留软件重用提供代方案
■正常软件根据第5章至第9章进行设计开发过程;
■遗留软件可按照4.4.2至4.4.5所述证实遗留软件的符合性。
4.4.2风险管理活动
a)评估与遗留软件有关的反馈信息,包括事件和或近事件、生产后信息
b)实施与继续使用遗留软件相关的风险管理活动,并考虑以下方面
■在整个医疗器械体系结构中遗留软件的集成情况;
■已实施的风险控制措施的持续有效性;
■识别与遗留软件继续使用相关的危险情况、促成危险情况的潜在原因、针对每个潜在原因,确定风险控制措施。
4.4.3差距分析
■ 基于遗留软件的软件安全级别(见4.3)
根据5.2,5.3,5.7和第7章的要求对可获得的交付物进行
5.2(需求分析)
5.3(软件体系结设计)
5.7(软件系统测试)
第7章(软件风险管理过程)
■分析的内容
——评估可获得的交付物的持续有效性。
——如果识别到差距:要不要生成缺失的交付物?会不会导致风险降低?
■分析后的活动
——确定拟创建的交付物和拟执行的相关活动。
——交付物最少应为软件系统测试录(见575)。
——在遗留软件中实施的风险控制措施包含在软件需求中。
4.4.4差距关闭活动
■涉及的内容
建立执行生成所识别的交付物的计划
若可获得,可使用减生成所的交忖物,而不执行5.2,5.3,5.7和第7章所要求的活动。
注:以上计划可包含在软件维护计划中(见6.1)。
——阐述怎样利用问题解决过程,依照第9章处理在遗留软件和交付物中发现的问题
——对遗留软件的变更应按照第6章进行。
4.4.5 使用遗留软件的理由
——将遗留软件的版本以及继续使用遗留软件的理由形成文件
后面的变化不大,故此没了==